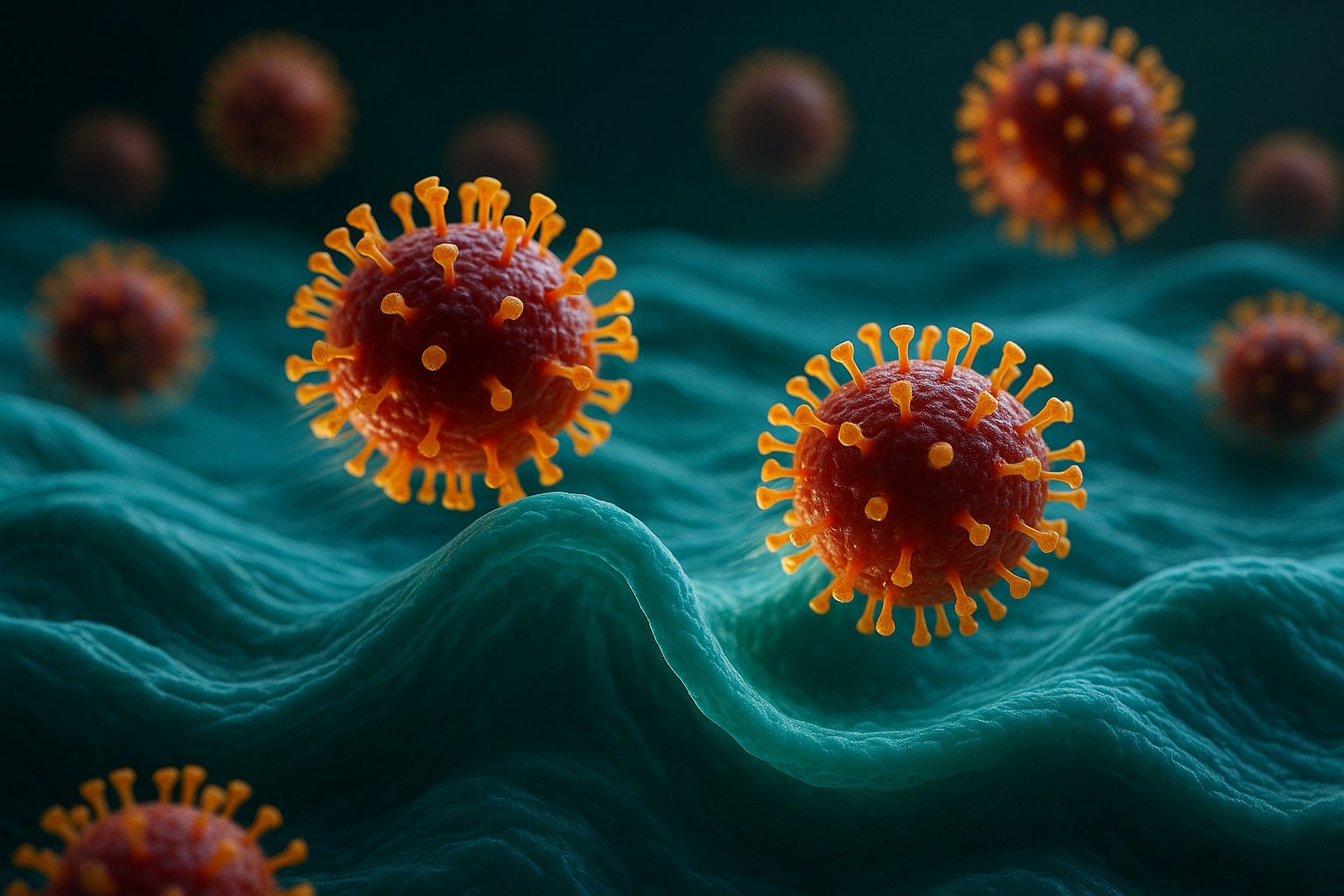
Une équipe internationale dirigée par l’ETH Zurich et incluant des chercheurs au Japon a utilisé une nouvelle technique d’imagerie haute résolution pour observer en direct les virus de la grippe pénétrer dans les cellules humaines. Ce travail montre que les cellules s’engagent activement avec le virus, l’aidant à entrer dans un processus qui ressemble à du surf le long de la membrane cellulaire, et pourrait éclairer le développement de thérapies antivirales ciblées.
Les virus de la grippe causent des maladies saisonnières marquées par de la fièvre, des douleurs aux membres et un écoulement nasal, entrant dans le corps par des gouttelettes puis infectant les cellules des voies respiratoires, rapporte l’ETH Zurich.
Des chercheurs de Suisse et du Japon ont désormais examiné ce processus d’infection avec un niveau de détail inédit. À l’aide d’une technique de microscopie qu’ils ont développée eux-mêmes, l’équipe peut zoomer sur la surface de cellules humaines cultivées en boîte de Petri et observer, en direct et en haute résolution, comment des virus individuels de grippe A pénètrent dans des cellules vivantes.
L’étude, dirigée par Yohei Yamauchi, professeur de médecine moléculaire à l’ETH Zurich, a révélé que les cellules ne sont pas de simples victimes passives. Elles contribuent activement à l’absorption du virus. « L’infection de nos cellules corporelles ressemble à une danse entre le virus et la cellule », a déclaré Yamauchi.
Bien que les cellules n’y gagnent rien, le virus détourne un système d’absorption cellulaire de routine dont les cellules dépendent pour importer des substances essentielles telles que les hormones, le cholestérol et le fer.
Pour initier l’infection, un virus de la grippe se lie à des molécules spécifiques à la surface de la cellule. Selon l’ETH Zurich, le virus « surfe » ensuite efficacement le long de la membrane, s’attachant à des molécules successives et balayant la surface jusqu’à atteindre un site d’entrée où de nombreuses molécules réceptrices sont regroupées, permettant une absorption efficace.
Une fois que les récepteurs de la cellule détectent qu’un virus s’est attaché à la membrane, la cellule commence à s’enrouler autour de la particule. Une petite indentation, ou poche, se forme à cet endroit et est façonnée et stabilisée par la protéine structurelle clathrine. Au fur et à mesure que la poche s’approfondit, elle enferme le virus et se détache sous forme de vésicule. La cellule transporte cette vésicule à l’intérieur, où son enveloppe se dissout et libère le virus.
Grâce à la nouvelle technique, les chercheurs ont montré que les cellules aident le virus à plusieurs étapes de ce processus. Elles recrutent activement des protéines de clathrine au site où le virus est lié, et la surface cellulaire se bombe vers le haut pour aider à capturer la particule. Ces mouvements ondulatoires de la membrane s’intensifient si le virus commence à s’éloigner de la surface.
Jusqu’à présent, les aspects clés de la pénétration de la grippe avaient été étudiés principalement par microscopie électronique, qui nécessite de fixer et détruire les cellules et ne fournit donc que des instantanés statiques, ou par microscopie à fluorescence, qui offre une résolution spatiale inférieure et une vision limitée des dynamiques de surface à l’échelle nanométrique.
La nouvelle approche, appelée virus‑view dual confocal and AFM (ViViD‑AFM), combine la microscopie à force atomique et la microscopie à fluorescence pour suivre les dynamiques à petite échelle de la pénétration virale en temps réel. La méthode est décrite en détail dans un article intitulé Enhanced visualization of influenza A virus entry into living cells using virus‑view atomic force microscopy, publié dans les Proceedings of the National Academy of Sciences en septembre 2025.
Puisque ViViD‑AFM permet aux scientifiques d’observer l’infection en direct, l’équipe de l’ETH Zurich estime qu’elle offre un moyen puissant de tester des candidats médicaments antiviraux directement en cultures cellulaires sous conditions réalistes. Les chercheurs notent également que la technique pourrait s’appliquer à l’étude d’autres virus ou même de vaccins, offrant des vues en temps réel de la manière dont diverses particules interagissent avec les cellules et sont absorbées.