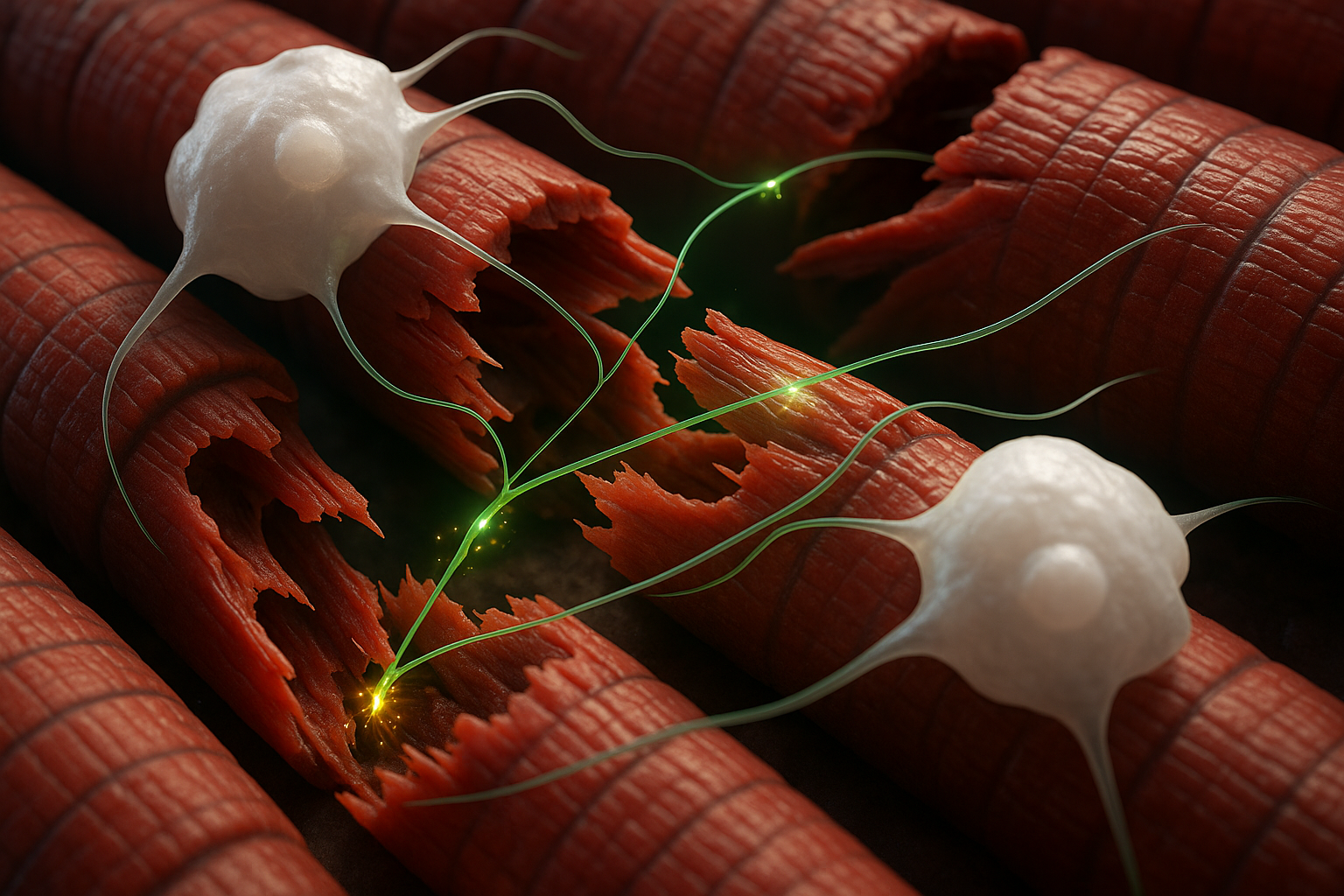
Pesquisadores do Cincinnati Children's Hospital Medical Center descobriram que certos macrófagos, um tipo de célula imune, podem formar conexões rápidas semelhantes a neurônios com fibras musculares para acelerar a cicatrização. Ao entregar pulsos rápidos de cálcio em músculo danificado, essas células desencadeiam atividade relacionada ao reparo em segundos. Os achados, publicados online em 21 de novembro de 2025 no Current Biology, podem eventualmente informar novos tratamentos para lesões musculares e condições degenerativas.
O reparo muscular varia dependendo do tipo de dano, desde lesões esportivas agudas até condições crônicas como distrofia muscular. Uma equipe de pesquisa do Cincinnati Children's Hospital Medical Center identificou um mecanismo compartilhado que parece aprimorar a recuperação em múltiplas formas de dano muscular.
O estudo, publicado online em 21 de novembro de 2025 no Current Biology, foi liderado pela primeira autora Gyanesh Tripathi, PhD, e pelo autor correspondente Michael Jankowski, PhD, que lidera a Divisão de Pesquisa no Departamento de Anestesia do Cincinnati Children's e atua como Diretor Associado de Pesquisa em Ciência Básica para o Pediatric Pain Research Center.
O processo recém-identificado centra-se em macrófagos, um tipo de célula imune mais conhecido por eliminar bactérias, células mortas e outros detritos. De acordo com o Cincinnati Children's, a equipe descobriu que macrófagos infiltrantes específicos podem formar contatos semelhantes a sinapses com miofibras, as células musculares que compõem o tecido muscular esquelético.
A descoberta surgiu de um trabalho originalmente voltado para aliviar a dor pós-cirúrgica. Em vez de uma nova estratégia de alívio da dor, os pesquisadores observaram uma resposta de reparo surpreendentemente rápida.
Em modelos de camundongos de duas formas de dano muscular —incisão aguda e lesão mais grave, incluindo dano semelhante a doenças—, a ativação quimiogenética breve de macrófagos com um composto projetado levou as células a liberar íons de cálcio diretamente para fibras musculares próximas. Em cerca de 10 a 30 segundos, os pesquisadores registraram transientes de cálcio e atividade elétrica de baixo nível no músculo lesionado, acompanhados de contrações musculares sutis.
"Isso ocorre de forma muito rápida. Você pode ativar o macrófago e fazer o músculo contrair sutilmente quase imediatamente", disse Jankowski, de acordo com materiais do Cincinnati Children's. O estudo relata que o efeito envolve macrófagos infiltrantes que chegam após o dano, em vez de células imunes residentes já no tecido.
Em modelos de camundongos que simulam dano muscular semelhante à distrofia muscular, o mesmo tipo de sinalização impulsionada por macrófagos ajudou a organizar células imunes nos locais de lesão e desencadeou ondas de atividade nas fibras musculares afetadas. Após 10 dias, camundongos que receberam ativação de macrófagos mostraram substancialmente mais novas fibras musculares do que animais de controle, relataram os autores.
"A maior surpresa disso foi descobrir que um macrófago tem uma propriedade semelhante a sinapse que entrega um íon para uma fibra muscular para facilitar seu reparo após uma lesão", disse Jankowski em um comunicado divulgado pelo Cincinnati Children's. "É literalmente como um neurônio funciona, e opera de forma extremamente rápida semelhante a sinapse para regular o reparo."
Apesar da resposta de cicatrização acelerada, os experimentos não revelaram uma redução correspondente na dor aguda. Os pesquisadores observam que entender por que cerca de 20% das crianças submetidas a cirurgia continuam a experimentar dor de longo prazo pode ser um passo importante a seguir.
Trabalhos futuros explorarão se macrófagos humanos exibem comportamento semelhante a sinapses e se tais células poderiam ser usadas como veículos de entrega para sinais ou materiais terapêuticos adicionais. Coautores do estudo incluem Adam Dourson, PhD, Fabian Montecino-Morales, PhD, Jennifer Wayland, MS, Sahana Khanna, Megan Hofmann, Hima Bindu Durumutla, MS, Thirupugal Govindarajan, PhD, Luis Queme, MD, PhD, e Douglas Millay, PhD. A pesquisa foi apoiada por bolsas do National Institutes of Health e da Cincinnati Children's Hospital Research Foundation.