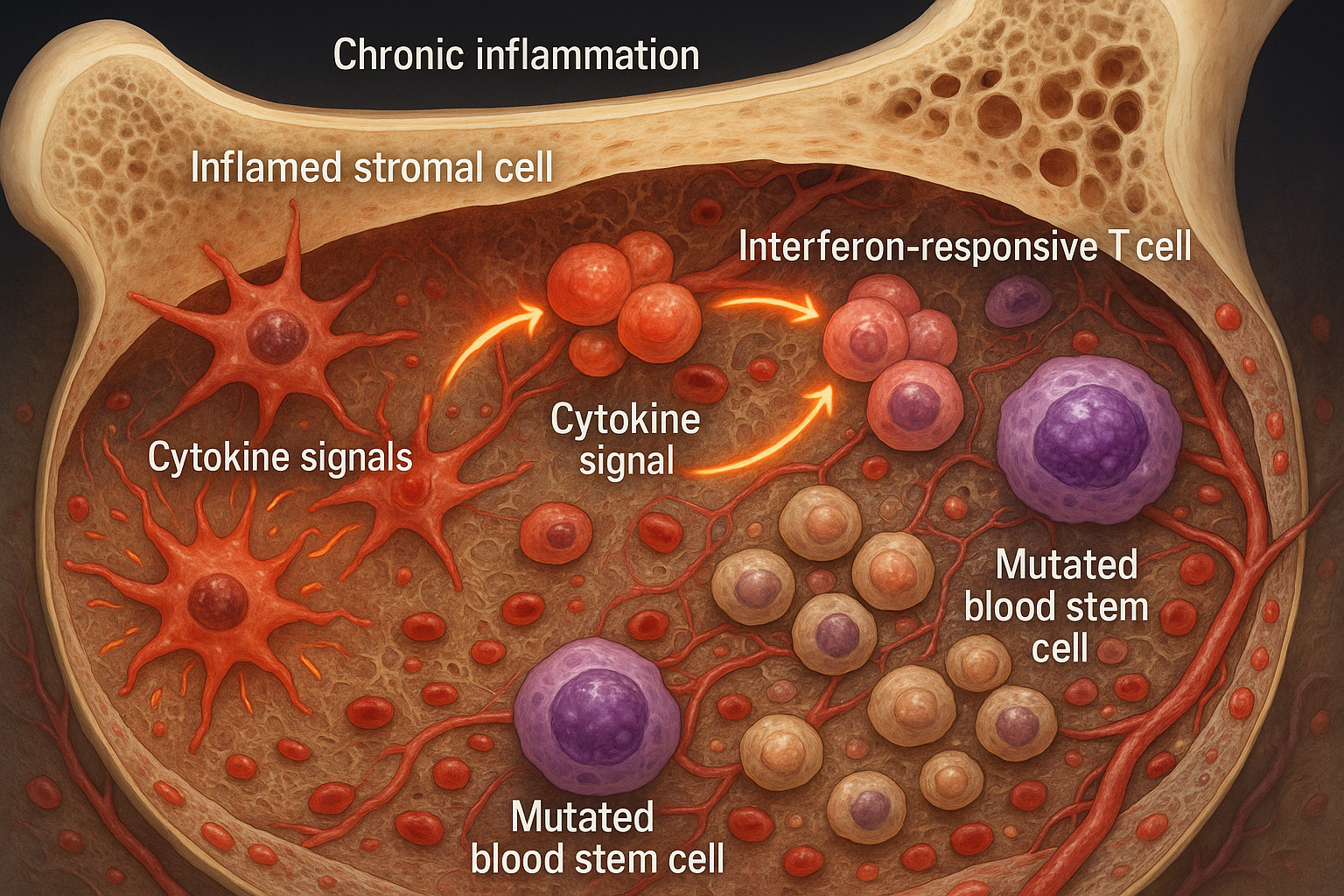
A inflamação crônica remodela o nicho da medula óssea, fomentando a expansão de células-tronco sanguíneas mutadas observadas na hematopoiese clonal e na mielodisplasia inicial. O trabalho, publicado em 18 de novembro de 2025 na Nature Communications, mapeia um ciclo de realimentação positiva entre células estromais inflamatórias e células T responsivas à interferon e aponta para terapias que visam o microambiente, bem como as células mutantes.
O que o estudo encontrou
Uma equipe internacional co-liderada por Judith Zaugg (EMBL/Universidade de Basel) e Borhane Guezguez (UMC Mainz) analisou medula óssea humana de indivíduos com hematopoiese clonal de potencial indeterminado (CHIP) e pacientes com síndrome mielodisplásica (MDS). Eles relatam que o microambiente da medula se inflama precocemente, com células estromais mesenquimais inflamatórias (iMSCs) e células T responsivas à interferon formando um circuito que compromete a produção sanguínea saudável. O estudo foi publicado em 18 de novembro de 2025 na Nature Communications. (dx.doi.org)
De acordo com a EMBL, o CHIP ocorre em cerca de 10–20% dos adultos acima de 60 anos e quase 30% acima de 80, e está associado a um risco dez vezes maior de cânceres sanguíneos e cerca de um aumento de duas vezes em doenças cardiovasculares e morte prematura. A MDS afeta até 20 em 100.000 pessoas acima de 70 anos, com cerca de 30% dos casos progredindo para leucemia mieloide aguda. (embl.org)
Como eles fizeram
Usando sequenciamento de RNA de célula única, imagem de biópsias, proteômica e modelos de cocultura, a equipe mapeou mudanças nos compartimentos estromais, hematopoéticos e de células T. Eles observaram que as iMSCs gradualmente substituem as células estromais mesenquimais de suporte e secretam citocinas induzidas por interferon que atraem e ativam células T, sustentando a inflamação. (sciencedaily.com)
Os pesquisadores separaram células mutadas de não mutadas com SpliceUp, um método computacional, e descobriram que as células-tronco MDS falharam em induzir a produção de CXCL12 por células estromais—um sinal importante para homing e suporte de células sanguíneas. (sciencedaily.com)
Nuância importante
Materiais de imprensa enfatizam que a equipe não viu um efeito inflamatório direto atribuível a células hematopoéticas mutantes em suas análises. O artigo da Nature Communications adiciona contexto de estágio da doença: enquanto HSPCs saudáveis envelhecidas e CHIP ativaram suporte estromal e HSPCs MDS falharam nisso, blasts MDS suprimiram ainda mais o suporte e desencadearam inflamação—apontando para remodelação microambiental que precede e depois se intensifica com a progressão da doença. (sciencedaily.com)
Por que importa
As descobertas posicionam o nicho da medula óssea—não apenas células mutantes—como alvo terapêutico. Os autores e resumos institucionais sugerem que abordagens anti-inflamatórias ou modulação da sinalização de interferon poderiam ajudar a preservar a função da medula ou desacelerar transições de CHIP para MDS ou AML; assinaturas moleculares de iMSCs e células T responsivas à interferon podem servir como biomarcadores precoces de risco. (sciencedaily.com)
Um estudo complementar da Nature Communications liderado por Marc Raaijmakers (Erasmus MC) relatou um eixo inflamatório de células T-estromal na MDS, reforçando a ideia de que interações imuno-estromais impulsionam a falha medular precoce e a evolução clonal. (embl.org)