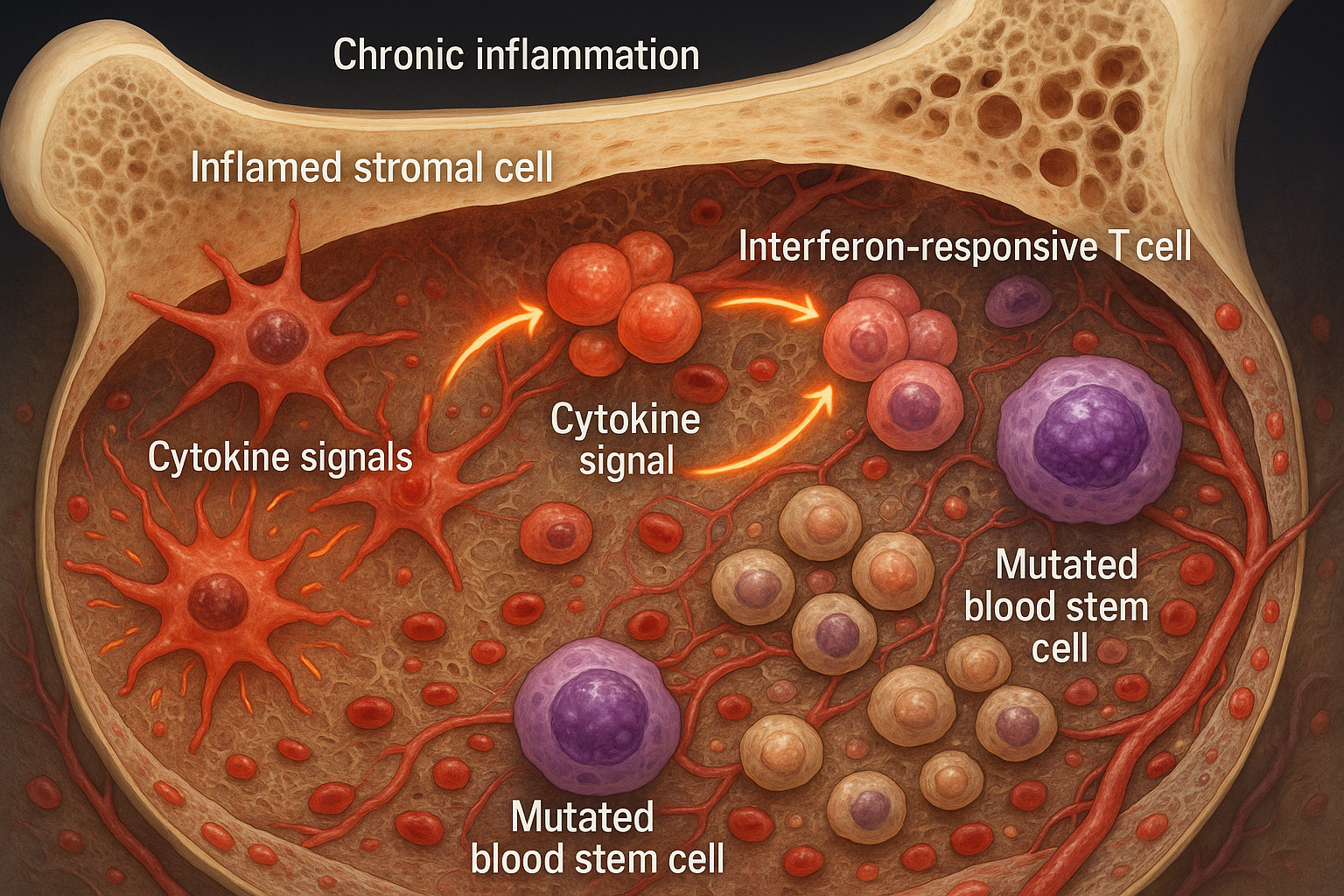
Kronisk inflammation omformar benmärgsnischen och främjar expansionen av muterade blodbildande stamceller som ses vid klonal hematopoies och tidig myelodysplasi. Arbetet, publicerat 18 november 2025 i Nature Communications, kartlägger en feed-forward-loop mellan inflammatoriska stromaceller och interferonresponsiva T-celler och pekar på behandlingar som riktar sig mot mikromiljön såväl som mutanta celler.
Vad studien fann
Ett internationellt team med Judith Zaugg (EMBL/Universitetet i Basel) och Borhane Guezguez (UMC Mainz) som medledare analyserade humant benmärg från individer med klonal hematopoies av obestämd potential (CHIP) och patienter med myelodysplastiskt syndrom (MDS). De rapporterar att benmärgsmikromiljön blir inflammerad tidigt, med inflammatoriska mesenkymala stromaceller (iMSCs) och interferonresponsiva T-celler som bildar en krets som underminerar frisk blodproduktion. Studien publicerades 18 november 2025 i Nature Communications. (dx.doi.org)
Enligt EMBL förekommer CHIP hos cirka 10–20 % av vuxna över 60 år och nästan 30 % över 80 år, och är associerat med en tiofaldigt högre risk för blodsjukdomar och cirka en fördubbling av risken för hjärt-kärlsjukdomar och förtida död. MDS drabbar upp till 20 per 100 000 personer över 70 år, med cirka 30 % av fallen som progredierar till akut myeloisk leukemi. (embl.org)
Hur de gjorde det
Med single-cell RNA-sekvensering, bildtagning av biopsier, proteomik och co-kulturmodeller kartlade teamet förändringar över stromala, hematopoetiska och T-cells-kompartment. De observerade att iMSCs gradvis ersätter stödjande mesenkymala stromaceller och utsöndrar interferoninducerade cytokiner som attraherar och aktiverar T-celler, och upprätthåller inflammation. (sciencedaily.com)
Forskare separerade muterade från icke-mutanta celler med SpliceUp, en beräkningsmetod, och fann att MDS-stamceller misslyckades med att inducera CXCL12-produktion av stromaceller—en signal viktig för homing och stöd av blodceller. (sciencedaily.com)
Viktig nyans
Pressmaterial betonar att teamet inte såg en direkt inflammatorisk effekt tillskriven mutanta hematopoetiska celler i sina analyser. Nature Communications-pappret lägger till sjukdomsstads-kontext: medan friska åldrande och CHIP HSPCs aktiverade stromalt stöd och MDS HSPCs misslyckades med det, undertryckte MDS-blasts stödet ytterligare och utlöste inflammation—pekande på mikromiljöomstrukturering som föregår, och sedan intensifieras med, sjukdomsprogression. (sciencedaily.com)
Varför det spelar roll
Resultaten positionerar benmärgsnischen—inte bara mutanta celler—som ett terapeutiskt mål. Författarna och institutionella sammanfattningar föreslår att antiinflammatoriska tillvägagångssätt eller modulering av interferonsignalering kan hjälpa till att bevara märgfunktion eller bromsa övergångar från CHIP till MDS eller AML; molekylära signaturer av iMSCs och interferonresponsiva T-celler kan tjäna som tidiga biomarkörer för risk. (sciencedaily.com)
En kompletterande Nature Communications-studie ledd av Marc Raaijmakers (Erasmus MC) rapporterade en inflammatorisk T-cell–stromal axel i MDS, vilket förstärker idén att immun–stromala interaktioner driver tidig märgsvikt och klonal evolution. (embl.org)