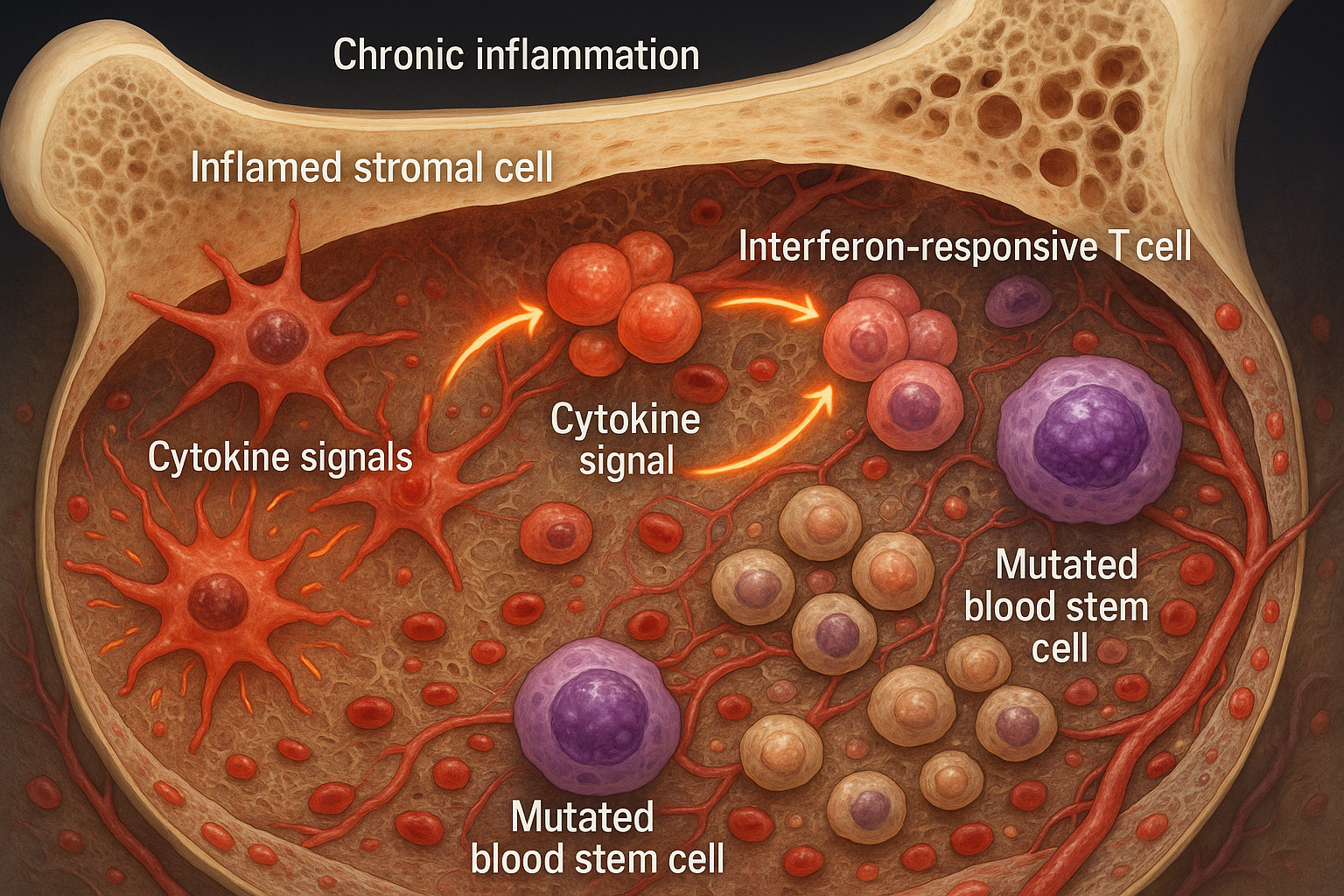
La inflamación crónica remodela el nicho de la médula ósea, fomentando la expansión de células madre sanguíneas mutadas observadas en la hematopoyesis clonal y la mielodisplasia temprana. El trabajo, publicado el 18 de noviembre de 2025 en Nature Communications, mapea un bucle de retroalimentación positiva entre células estromales inflamatorias y células T responsivas a interferón, y apunta a terapias que apunten al microambiente así como a las células mutantes.
Lo que encontró el estudio
Un equipo internacional codirigido por Judith Zaugg (EMBL/Universidad de Basilea) y Borhane Guezguez (UMC Mainz) analizó médula ósea humana de individuos con hematopoyesis clonal de potencial indeterminado (CHIP) y pacientes con síndrome mielodisplásico (MDS). Informan que el microambiente de la médula se inflama tempranamente, con células estromales mesenquimales inflamatorias (iMSCs) y células T responsivas a interferón formando un circuito que socava la producción sanguínea saludable. El estudio fue publicado el 18 de noviembre de 2025 en Nature Communications. (dx.doi.org)
Según EMBL, el CHIP ocurre en aproximadamente el 10–20% de los adultos mayores de 60 años y casi el 30% mayores de 80, y está asociado con un riesgo diez veces mayor de cánceres de sangre y alrededor de un aumento de dos veces en enfermedades cardiovasculares y muerte prematura. El MDS afecta hasta 20 en 100.000 personas mayores de 70 años, con alrededor del 30% de los casos progresando a leucemia mieloide aguda. (embl.org)
Cómo lo hicieron
Usando secuenciación de ARN de célula única, imagen de biopsias, proteómica y modelos de cocultivo, el equipo mapeó cambios en los compartimentos estromales, hematopoyéticos y de células T. Observaron que las iMSCs reemplazan gradualmente a las células estromales mesenquimales de soporte y secretan citoquinas inducidas por interferón que atraen y activan células T, sosteniendo la inflamación. (sciencedaily.com)
Los investigadores separaron células mutadas de no mutadas con SpliceUp, un método computacional, y encontraron que las células madre MDS no indujeron la producción de CXCL12 por células estromales—una señal importante para el homing y soporte de células sanguíneas. (sciencedaily.com)
Matiz importante
Los materiales de prensa enfatizan que el equipo no vio un efecto inflamatorio directo atribuible a células hematopoyéticas mutantes en sus análisis. El artículo de Nature Communications agrega contexto de etapa de la enfermedad: mientras que las HSPCs sanas envejecidas y CHIP activaron soporte estromal y las HSPCs MDS fallaron en hacerlo, los blastos MDS suprimieron aún más el soporte y desencadenaron inflamación—señalando una remodelación microambiental que precede y luego se intensifica con la progresión de la enfermedad. (sciencedaily.com)
Por qué importa
Los hallazgos posicionan el nicho de la médula ósea—no solo las células mutantes—como un objetivo terapéutico. Los autores y resúmenes institucionales sugieren que enfoques antiinflamatorios o modulación de la señalización de interferón podrían ayudar a preservar la función de la médula o ralentizar transiciones de CHIP a MDS o LMA; firmas moleculares de iMSCs y células T responsivas a interferón pueden servir como biomarcadores tempranos de riesgo. (sciencedaily.com)
Un estudio complementario de Nature Communications dirigido por Marc Raaijmakers (Erasmus MC) reportó un eje inflamatorio de células T-estromal en MDS, reforzando la idea de que interacciones inmuno-estromales impulsan el fallo temprano de la médula y la evolución clonal. (embl.org)