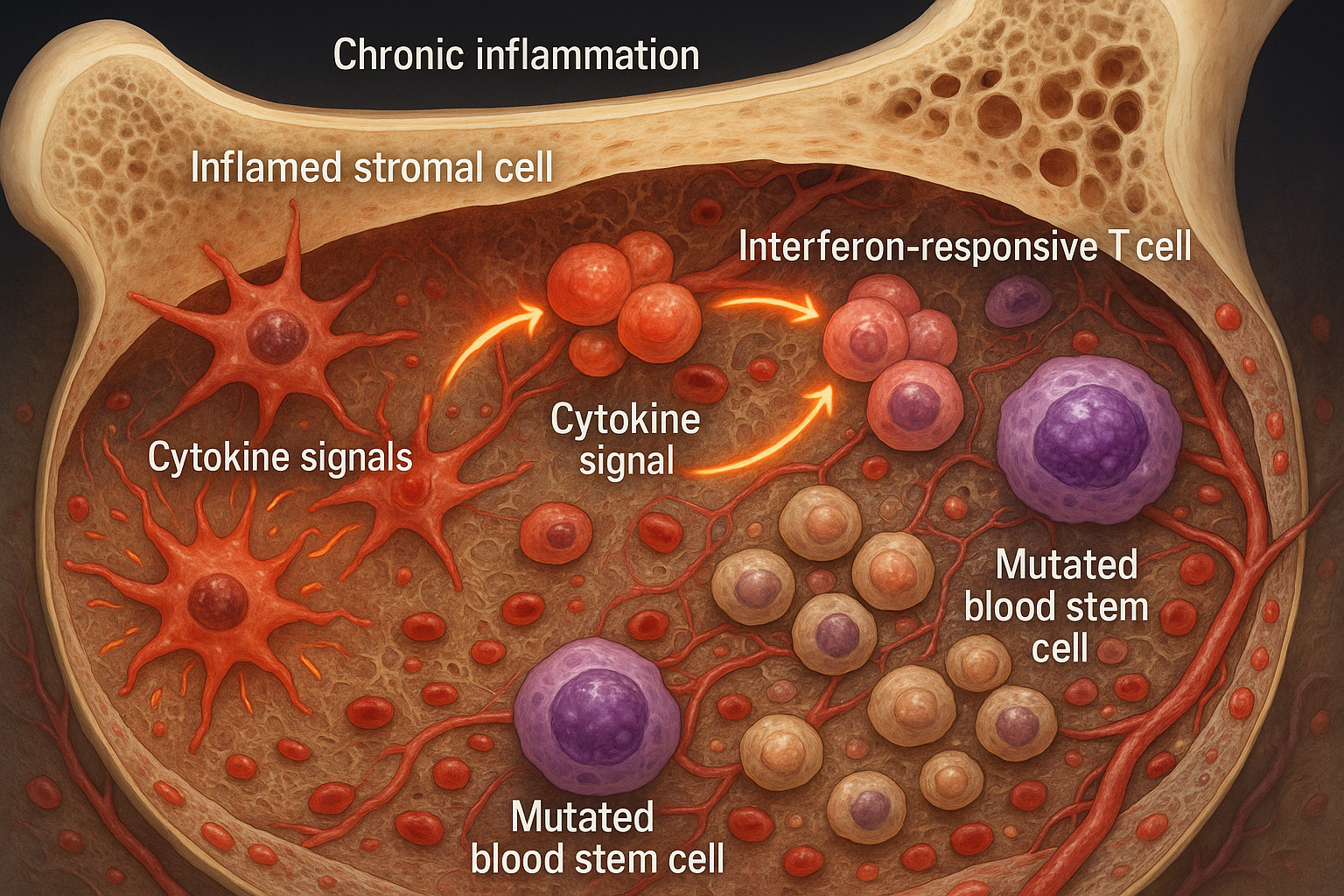
慢性炎症は骨髄ニッチを再形成し、クローナルhematopoiesisおよび早期骨髄異形成症で見られる変異血液幹細胞の拡大を促進します。この研究は、2025年11月18日にNature Communicationsに掲載され、炎症性間質細胞とインターフェロン応答性T細胞間のフィードフォワードループをマッピングし、微小環境および変異細胞を標的とする治療法を指摘しています。
研究の結果
Judith Zaugg(EMBL/バーゼル大学)とBorhane Guezguez(UMC Mainz)が共同主導する国際チームは、不確定可能性クローナルhematopoiesis(CHIP)を持つ個人および骨髄異形成症候群(MDS)患者のヒト骨髄を分析しました。彼らは、骨髄微小環境が早期に炎症を起こし、炎症性間質間葉細胞(iMSCs)とインターフェロン応答性T細胞が健康な血液産生を損なう回路を形成することを報告しています。この研究は2025年11月18日にNature Communicationsに掲載されました。(dx.doi.org)
EMBLによると、CHIPは60歳以上の成人の約10–20%、80歳以上のほぼ30%で発生し、血液がんのリスクが10倍高く、心血管疾患および早期死亡のリスクが約2倍増加します。MDSは70歳以上の10万人あたり最大20人を影響し、約30%の症例が急性骨髄性白血病に進行します。(embl.org)
方法
シングルセルRNAシーケンシング、生検画像、プロテオミクス、およびコカルチャーモデルを使用して、チームは間質、造血、T細胞コンパートメント全体の変化をマッピングしました。彼らは、iMSCsが徐々に支持性間質間葉細胞を置き換え、インターフェロン誘導性サイトカインを分泌してT細胞を引きつけ活性化し、炎症を維持することを観察しました。(sciencedaily.com)
研究者は計算手法SpliceUpを使用して変異細胞と非変異細胞を分離し、MDS幹細胞が間質細胞によるCXCL12産生を誘導できなかったことを発見しました—これは血液細胞のホーミングと支持に重要なシグナルです。(sciencedaily.com)
重要なニュアンス
プレス資料は、分析で変異造血細胞に帰属する直接的な炎症効果をチームが見なかったことを強調しています。Nature Communicationsの論文は疾患ステージの文脈を追加:健康な高齢者およびCHIPのHSPCsが間質支持を活性化しMDSのHSPCsが失敗した一方、MDSのブラストは支持をさらに抑制し炎症を引き起こしました—疾患進行に先立つ微小環境のリモデリングを示しています。(sciencedaily.com)
なぜ重要か
これらの発見は骨髄ニッチ—変異細胞だけでなく—を治療標的として位置づけます。著者および機関の要約は、抗炎症アプローチまたはインターフェロンシグナリングの変調が骨髄機能を保存したりCHIPからMDSやAMLへの移行を遅らせたりする可能性を提案;iMSCsおよびインターフェロン応答性T細胞の分子シグネチャはリスクの早期バイオマーカーとして機能する可能性があります。(sciencedaily.com)
Marc Raaijmakers(Erasmus MC)が主導する補完的なNature Communications研究は、MDSにおける炎症性T細胞–間質軸を報告し、免疫–間質相互作用が早期骨髄不全とクローナル進化を駆動するという考えを強化しています。(embl.org)