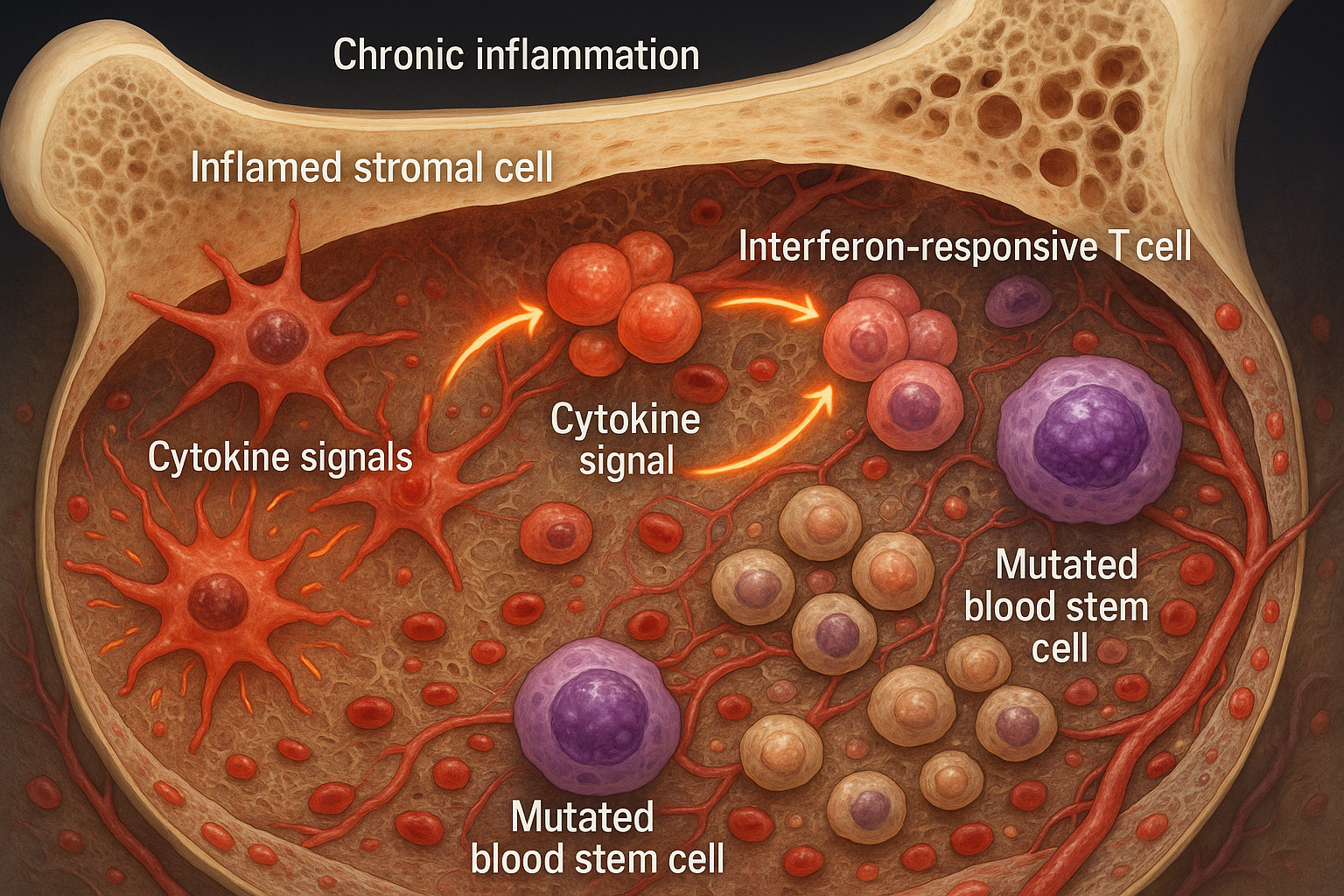
L'inflammation chronique remodèle le niche de la moelle osseuse, favorisant l'expansion des cellules souches sanguines mutées observées dans l'hématopoïèse clonale et la myélodysplasie précoce. Ce travail, publié le 18 novembre 2025 dans Nature Communications, cartographie une boucle d'alimentation positive entre les cellules stromales inflammatoires et les cellules T réactives à l'interféron et pointe vers des thérapies ciblant le microenvironnement ainsi que les cellules mutantes.
Ce que l'étude a trouvé
Une équipe internationale codirigée par Judith Zaugg (EMBL/Université de Bâle) et Borhane Guezguez (UMC Mainz) a analysé la moelle osseuse humaine d'individus présentant une hématopoïèse clonale de potentiel indéterminé (CHIP) et de patients atteints de syndrome myélodysplasique (MDS). Ils rapportent que le microenvironnement de la moelle s'enflamme précocement, avec des cellules stromales mésenchymateuses inflammatoires (iMSCs) et des cellules T réactives à l'interféron formant un circuit qui sape la production sanguine saine. L'étude a été publiée le 18 novembre 2025 dans Nature Communications. (dx.doi.org)
Selon l'EMBL, le CHIP touche environ 10–20 % des adultes de plus de 60 ans et près de 30 % de ceux de plus de 80 ans, et est associé à un risque dix fois plus élevé de cancers du sang et environ un doublement du risque de maladies cardiovasculaires et de mort prématurée. Le MDS affecte jusqu'à 20 personnes sur 100 000 de plus de 70 ans, avec environ 30 % des cas progressant vers une leucémie myéloïde aiguë. (embl.org)
Comment ils l'ont fait
En utilisant le séquençage d'ARN monocellulaire, l'imagerie de biopsies, la protéomique et des modèles de coculture, l'équipe a cartographié les changements dans les compartiments stromaux, hématopoïétiques et des cellules T. Ils ont observé que les iMSCs remplacent progressivement les cellules stromales mésenchymateuses de soutien et sécrètent des cytokines induites par l'interféron qui attirent et activent les cellules T, maintenant l'inflammation. (sciencedaily.com)
Les chercheurs ont séparé les cellules mutées des non mutées avec SpliceUp, une méthode computationnelle, et ont découvert que les cellules souches MDS n'ont pas réussi à induire la production de CXCL12 par les cellules stromales—un signal important pour l'homing et le soutien des cellules sanguines. (sciencedaily.com)
Nuance importante
Les supports de presse soulignent que l'équipe n'a pas observé d'effet inflammatoire direct attribuable aux cellules hématopoïétiques mutantes dans leurs analyses. L'article de Nature Communications ajoute un contexte de stade de la maladie : tandis que les HSPCs saines âgées et CHIP ont activé le soutien stromal et que les HSPCs MDS ont échoué à le faire, les blasts MDS ont encore plus supprimé le soutien et déclenché l'inflammation—indiquant un remodelage microenvironnemental qui précède, puis s'intensifie avec, la progression de la maladie. (sciencedaily.com)
Pourquoi cela compte
Les résultats positionnent le niche de la moelle osseuse—pas seulement les cellules mutantes—comme une cible thérapeutique. Les auteurs et résumés institutionnels suggèrent que des approches anti-inflammatoires ou une modulation de la signalisation de l'interféron pourraient aider à préserver la fonction de la moelle ou à ralentir les transitions de CHIP à MDS ou LMA ; les signatures moléculaires des iMSCs et des cellules T réactives à l'interféron pourraient servir de biomarqueurs précoces de risque. (sciencedaily.com)
Une étude complémentaire de Nature Communications dirigée par Marc Raaijmakers (Erasmus MC) a rapporté un axe inflammatoire cellules T-stromal dans le MDS, renforçant l'idée que les interactions immun-stromales conduisent à une insuffisance médullaire précoce et à l'évolution clonale. (embl.org)