Investigadores del Cincinnati Children's Hospital Medical Center han descubierto que ciertos macrófagos, un tipo de célula inmune, pueden formar conexiones rápidas similares a las de las neuronas con las fibras musculares para acelerar la curación. Al entregar pulsos rápidos de calcio en el músculo dañado, estas células desencadenan actividad relacionada con la reparación en segundos. Los hallazgos, publicados en línea el 21 de noviembre de 2025 en *Current Biology*, podrían informar eventualmente nuevos tratamientos para lesiones musculares y condiciones degenerativas.
La reparación muscular varía según el tipo de daño, desde lesiones deportivas agudas hasta condiciones crónicas como la distrofia muscular. Un equipo de investigación del Cincinnati Children's Hospital Medical Center ha identificado un mecanismo compartido que parece mejorar la recuperación en múltiples formas de daño muscular.
El estudio, publicado en línea el 21 de noviembre de 2025 en Current Biology, fue liderado por la primera autora Gyanesh Tripathi, PhD, y el autor correspondiente Michael Jankowski, PhD, quien dirige la División de Investigación en el Departamento de Anestesia de Cincinnati Children's y sirve como Director Asociado de Investigación en Ciencias Básicas para el Pediatric Pain Research Center.
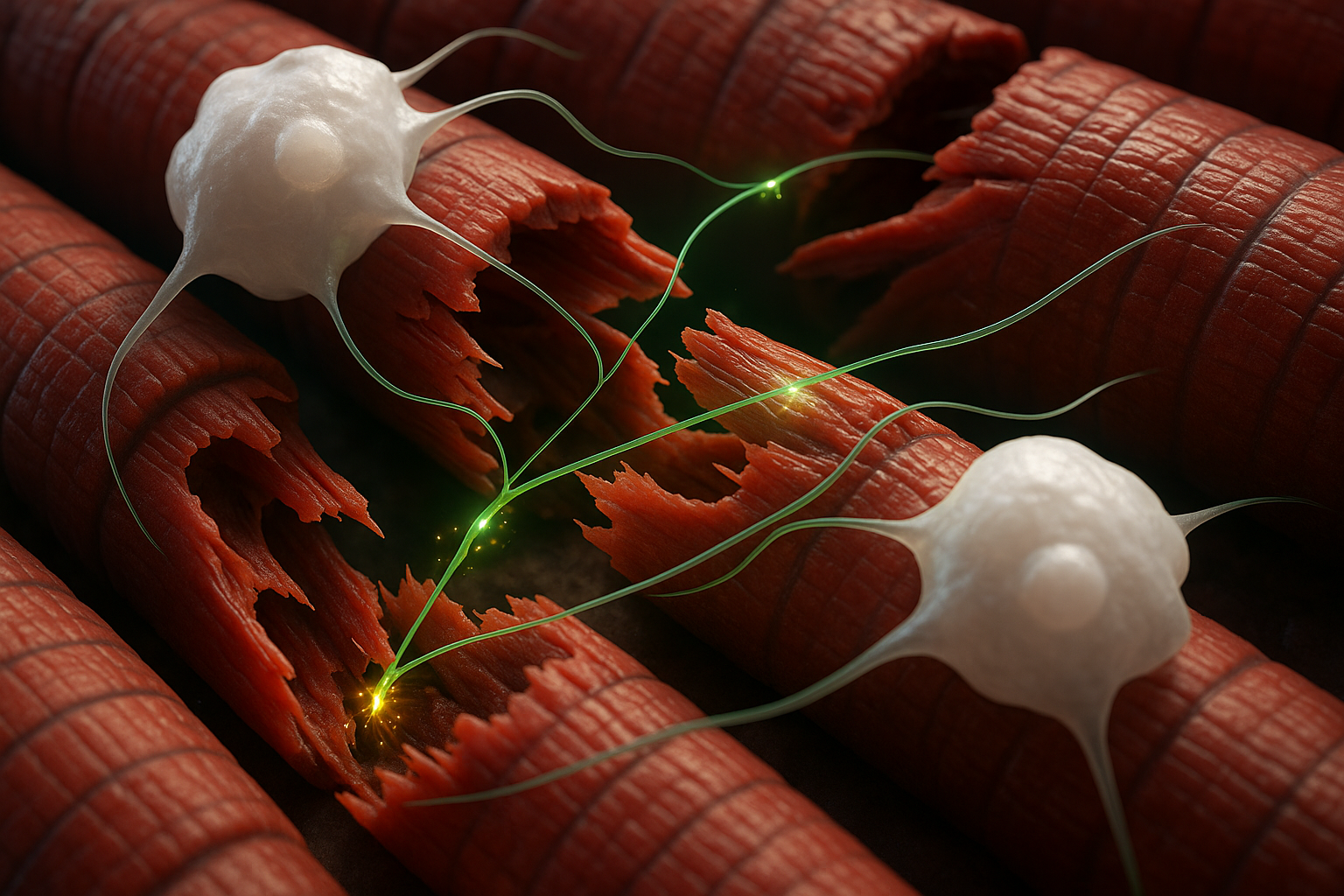
El proceso recién identificado se centra en los macrófagos, un tipo de célula inmune conocida principalmente por eliminar bacterias, células muertas y otros desechos. Según Cincinnati Children's, el equipo encontró que macrófagos infiltrantes específicos pueden formar contactos similares a sinapsis con las miofibras, las células musculares que componen el tejido muscular esquelético.
El descubrimiento surgió de un trabajo originalmente dirigido a aliviar el dolor postquirúrgico. En lugar de una nueva estrategia de alivio del dolor, los investigadores observaron una respuesta de reparación sorprendentemente rápida.
En modelos de ratón de dos formas de daño muscular —incisión aguda y lesión más grave, incluyendo daño similar a enfermedades—, una breve activación quimiogenética de macrófagos con un compuesto diseñado provocó que las células liberaran iones de calcio directamente a las fibras musculares cercanas. En unos 10 a 30 segundos, los investigadores registraron transitorios de calcio y actividad eléctrica de bajo nivel en el músculo lesionado, acompañados de contracciones musculares sutiles.
"Esto ocurre de manera muy rápida. Puedes activar el macrófago y hacer que el músculo se contraiga sutilmente casi de inmediato", dijo Jankowski, según materiales de Cincinnati Children's. El estudio informa que el efecto involucra macrófagos infiltrantes que llegan después del daño, en lugar de células inmunes residentes ya en el tejido.
En modelos de ratón que imitan daño muscular similar a la distrofia muscular, el mismo tipo de señalización impulsada por macrófagos ayudó a organizar células inmunes en los sitios de lesión y desencadenó ondas de actividad en las fibras musculares afectadas. Después de 10 días, los ratones que recibieron activación de macrófagos mostraron sustancialmente más fibras musculares nuevas que los animales de control, informaron los autores.
"La mayor sorpresa de esto fue descubrir que un macrófago tiene una propiedad similar a una sinapsis que entrega un ion a una fibra muscular para facilitar su reparación después de una lesión", dijo Jankowski en un comunicado emitido por Cincinnati Children's. "Es literalmente como funciona una neurona, y opera de manera extremadamente rápida similar a una sinapsis para regular la reparación."
A pesar de la respuesta de curación acelerada, los experimentos no revelaron una reducción correspondiente en el dolor agudo. Los investigadores señalan que entender por qué aproximadamente el 20% de los niños que se someten a cirugía continúan experimentando dolor a más largo plazo podría ser un paso importante siguiente.
El trabajo futuro explorará si los macrófagos humanos muestran un comportamiento similar a sinapsis y si tales células podrían usarse como vehículos de entrega para señales o materiales terapéuticos adicionales. Los coautores del estudio incluyen a Adam Dourson, PhD, Fabian Montecino-Morales, PhD, Jennifer Wayland, MS, Sahana Khanna, Megan Hofmann, Hima Bindu Durumutla, MS, Thirupugal Govindarajan, PhD, Luis Queme, MD, PhD, y Douglas Millay, PhD. La investigación fue apoyada por subvenciones del National Institutes of Health y la Cincinnati Children's Hospital Research Foundation.