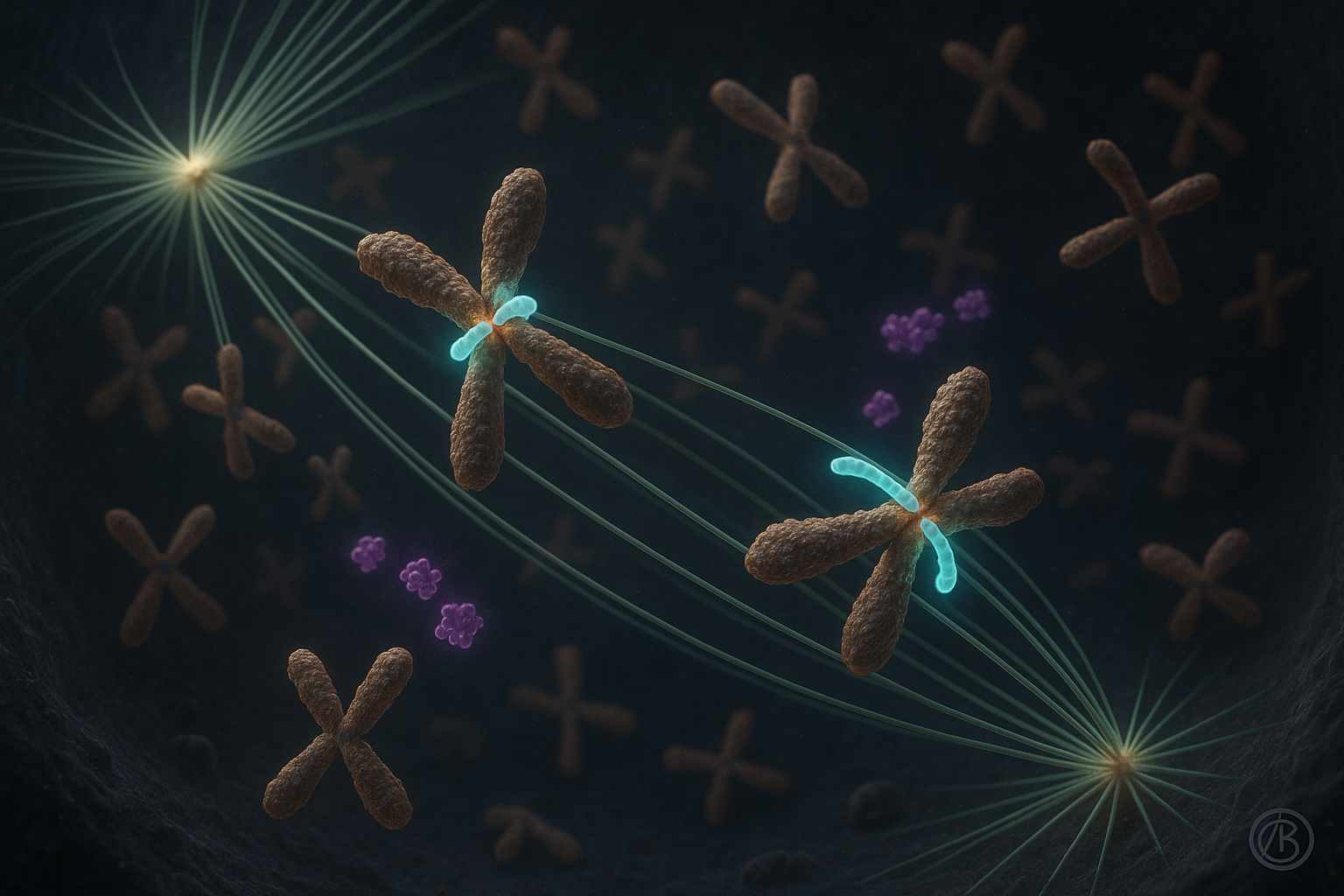
Des chercheurs de l’Institut Ruđer Bošković à Zagreb rapportent que la protéine CENP-E joue un rôle crucial dans la stabilisation des premières attachments entre chromosomes et microtubules lors de la division cellulaire, plutôt que d’agir principalement comme un moteur qui tire les chromosomes en place. Ce travail, décrit dans deux études publiées dans Nature Communications, révise les modèles de longue date de la congression chromosomique en liant la fonction de CENP-E aux kinases Aurora et en suggérant des implications pour la compréhension des maladies marquées par des erreurs de ségrégation chromosomique.
La division cellulaire nécessite un alignement précis des chromosomes afin que chaque cellule fille reçoive une copie exacte du matériel génétique. Des erreurs dans ce processus peuvent entraîner infertilité, troubles du développement et cancer, une connexion largement documentée dans la recherche en biologie cellulaire.
Pendant près de deux décennies, le modèle dominant supposait que CENP-E, une protéine motrice du kinétochore, transportait les chromosomes mal alignés vers le centre du fuseau cellulaire principalement en les faisant glisser le long des microtubules. Un travail récent d’une équipe dirigée par le Dr Kruno Vukušić et la Professeure Iva M. Tolić à l’Institut Ruđer Bošković remet en question cette vue.
Dans l’un des nouveaux articles de Nature Communications, les auteurs rapportent que CENP-E est essentielle pour initier la congression chromosomique en promouvant et stabilisant les attachments end-on entre kinétochores et microtubules, en particulier pour les chromosomes qui commencent près des pôles du fuseau. Une fois ces attachments stables formés et la biorientation établie, le mouvement subséquent des chromosomes vers l’équateur du fuseau se poursuit avec des dynamiques similaires indépendamment de l’activité de CENP-E, selon l’étude.
La recherche montre en outre que les kinases Aurora A et Aurora B agissent comme inhibiteurs de cette étape d’initiation lorsque CENP-E est absente ou inactive, en partie en favorisant l’hyperphosphorylation des protéines de liaison aux microtubules et en maintenant une couronne fibreuse étendue aux kinétochores. CENP-E contrebalance la phosphorylation médiée par Aurora B de manière dépendante de BubR1, aidant à stabiliser les attachments end-on initiaux et à déclencher la transition de la liaison latérale à end-on.
Un article complémentaire de Nature Communications du même groupe étend ce tableau en proposant une boucle de rétroaction entre centrosomes et kinétochores dans laquelle l’activité d’Aurora A près des pôles du fuseau renforce Aurora B aux kinétochores, limitant ainsi le début de la congression lorsque CENP-E n’est pas fonctionnelle. Retirer les centrioles ou inhiber Aurora A relâche ce frein et peut permettre à la congression de commencer même sans CENP-E active, rapportent les auteurs.
Ensemble, les études suggèrent que la congression chromosomique se déroule en au moins deux phases biomécaniques : une phase d’initiation fortement dépendante de la capacité de CENP-E à stabiliser les attachments end-on face à l’activité des kinases Aurora, et une phase de mouvement subséquente dominée par la géométrie du fuseau et la dynamique des microtubules plutôt que par le transport piloté par CENP-E.
Les résultats révisent une description axée sur la force qui figurait dans les modèles de manuel de mitose, la remplaçant par un cadre régulateur dans lequel CENP-E, les kinases Aurora, BubR1 et d’autres composants du kinétochore coordonnent le timing et la localisation des attachments stables aux microtubules. Selon un résumé de l’Institut Ruđer Bošković, en clarifiant comment ces régulateurs moléculaires coopèrent, ce travail aide à expliquer comment les cellules maintiennent une haute fidélité pendant la division et peut éclairer les recherches futures sur les cancers et autres affections où la ségrégation chromosomique est fréquemment perturbée.
Les deux études ont été menées à l’Institut Ruđer Bošković et soutenues par des subventions du Conseil européen de la recherche et un financement national croate, et elles se sont appuyées sur une imagerie de cellules vivantes avancée et une analyse computationnelle pour suivre le comportement des chromosomes et la signalisation moléculaire pendant la mitose.