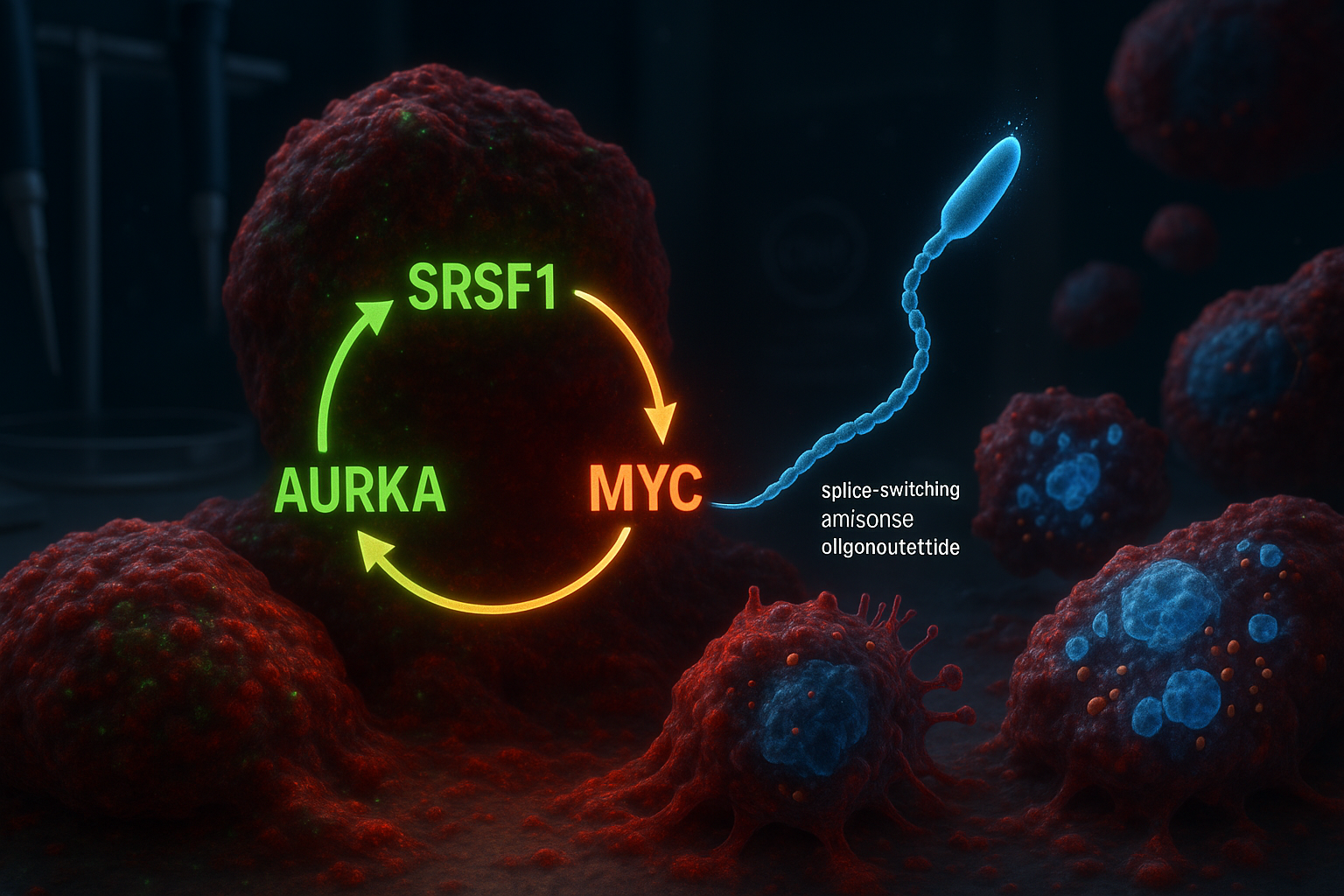
Des chercheurs du Cold Spring Harbor Laboratory rapportent avoir identifié un circuit moléculaire à trois volets impliquant SRSF1, l'Aurora kinase A (AURKA) et MYC qui contribue à propulser l'adénocarcinome canalaire pancréatique agressif. Dans des modèles de laboratoire, un oligonucléotide antisens à changement d'épissage conçu pour modifier l'épissage de AURKA a rompu le circuit, réduisant la viabilité des cellules tumorales et déclenchant la mort cellulaire programmée.
L'adénocarcinome canalaire pancréatique (PDAC) est la forme la plus courante et la plus mortelle de cancer du pancréas, et il est notoirement difficile à traiter. De nombreuses stratégies thérapeutiques se sont concentrées sur KRAS, un gène fréquemment muté dans le PDAC, mais les tumeurs peuvent contourner ces approches au fil du temps, alimentant l'intérêt pour des cibles moléculaires supplémentaires. Les chercheurs du Cold Spring Harbor Laboratory (CSHL) affirment que leur nouveau travail s'appuie sur des découvertes antérieures du laboratoire Krainer rapportées en 2023, qui ont identifié le régulateur d'épissage de l'ARN SRSF1 comme un déclencheur précoce de la formation de tumeurs PDAC. En réanalysant les données de cette étude antérieure, l'équipe — dirigée par l'ancien étudiant diplômé du CSHL Alexander Kral — a conclu que SRSF1 fonctionne dans un circuit d'auto-renforcement avec l'Aurora kinase A (AURKA) et l'oncogène MYC. Dans la boucle proposée, SRSF1 régule AURKA par épissage alternatif, augmentant les niveaux de AURKA. AURKA, à son tour, aide à stabiliser la protéine MYC, et MYC booste ensuite la production de SRSF1 — relançant le cycle et aidant à propulser un comportement de maladie plus agressif. « Notre théorie était que certains des changements causés par des niveaux accrus de SRSF1 jouaient un rôle dans la croissance tumorale accélérée que nous observions », a déclaré Kral, décrivant comment l'équipe s'est concentrée sur AURKA puis a cartographié le circuit plus large impliquant MYC. Pour essayer de briser la boucle, les chercheurs ont conçu des oligonucléotides antisens à changement d'épissage (ASO) destinés à modifier la manière dont AURKA est épissé. Le laboratoire Krainer travaille depuis longtemps sur la technologie ASO et a précédemment contribué au développement de nusinersen (Spinraza), un traitement approuvé par la FDA pour l'amyotrophie musculaire spinale. Dans des modèles cellulaires PDAC, l'équipe a rapporté que cibler l'épissage de AURKA a produit des effets plus larges que prévu : la perturbation du circuit était associée à une réduction de la viabilité cellulaire et à l'activation de l'apoptose. « C'est comme tuer trois oiseaux d'une pierre », a déclaré l'auteur principal Adrian Krainer. « SRSF1, AURKA et MYC sont tous des oncogènes contribuant à la progression du PDAC. En ciblant simplement l'épissage de AURKA avec notre ASO, nous observons également la perte de ces deux autres molécules. » L'étude, publiée dans Molecular Cell (en ligne le 30 décembre 2025 ; listée dans le volume 2026 de la revue), est une recherche en stade précoce et non un traitement clinique. Les chercheurs ont indiqué que des travaux supplémentaires seront nécessaires pour affiner l'approche ASO avant tout test potentiel chez les patients.