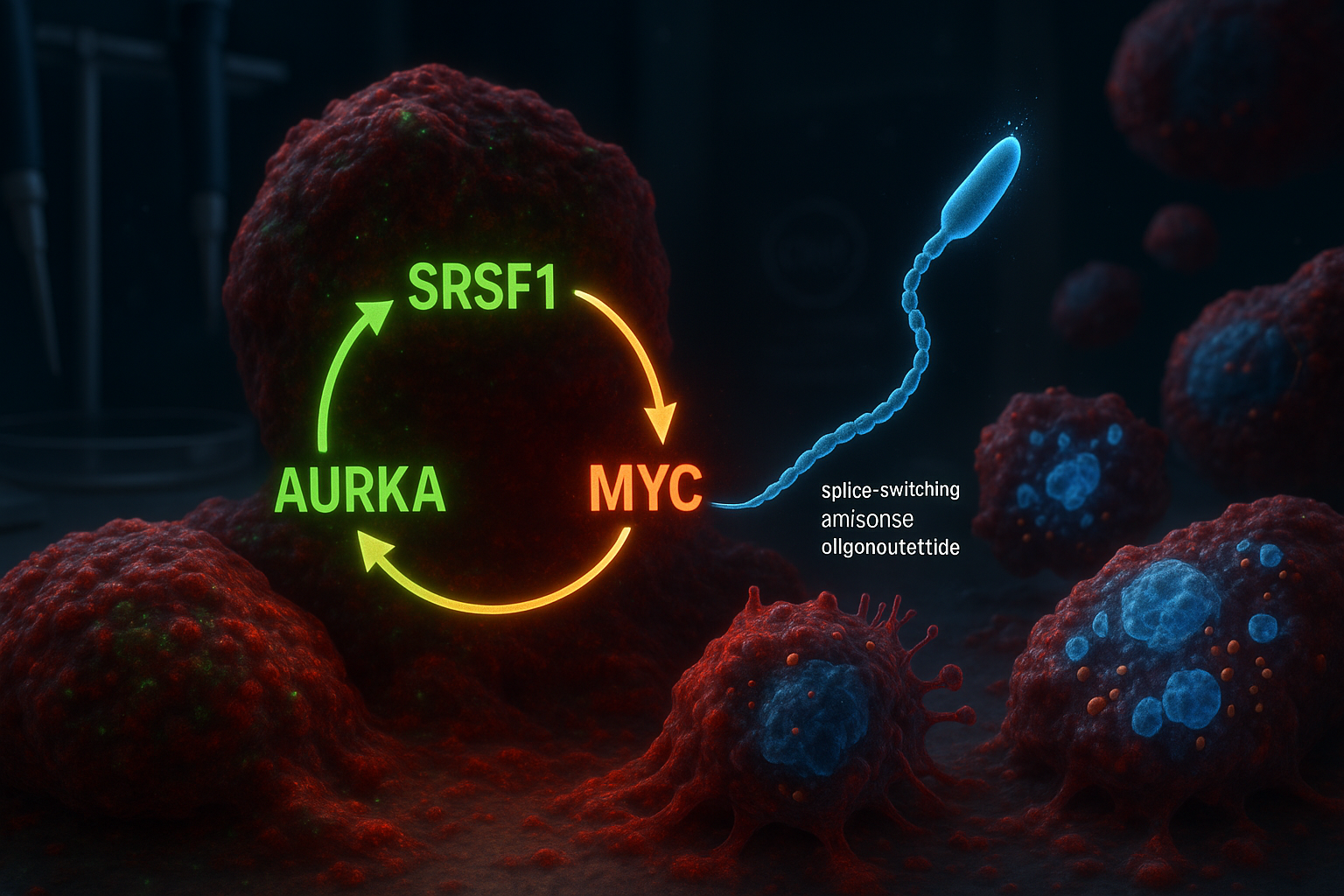
Investigadores del Laboratorio Cold Spring Harbor informan que han identificado un circuito molecular de tres partes que involucra a SRSF1, la aurora quinasa A (AURKA) y MYC, y que ayuda a impulsar el adenocarcinoma ductal pancreático agresivo. En modelos de laboratorio, un oligonucleótido antisentido de cambio de empalme diseñado para alterar el empalme de AURKA rompió el circuito, reduciendo la viabilidad de las células tumorales y activando la muerte celular programada.
El adenocarcinoma ductal pancreático (PDAC) es la forma más común y mortal de cáncer de páncreas, y es notoriamente difícil de tratar. Muchas estrategias terapéuticas se han centrado en KRAS, un gen frecuentemente mutado en PDAC, pero los tumores pueden evadir estos enfoques con el tiempo, lo que genera interés en objetivos moleculares adicionales. Los investigadores del Laboratorio Cold Spring Harbor (CSHL) dicen que su nuevo trabajo se basa en hallazgos anteriores del laboratorio de Krainer reportados en 2023, que identificaron al regulador de empalme de ARN SRSF1 como un desencadenante temprano de la formación de tumores PDAC. Al reanalizar datos de ese estudio previo, el equipo —liderado por el exestudiante graduado de CSHL Alexander Kral— concluyó que SRSF1 opera en un circuito de autorrefuerzo con la aurora quinasa A (AURKA) y el oncogén MYC. Dentro del bucle propuesto, SRSF1 regula AURKA mediante empalme alternativo, aumentando los niveles de AURKA. AURKA, a su vez, ayuda a estabilizar la proteína MYC, y MYC luego impulsa la producción de SRSF1, reiniciando el ciclo y ayudando a impulsar un comportamiento de enfermedad más agresivo. “Nuestra teoría era que algunos de los cambios causados por niveles elevados de SRSF1 estaban jugando un papel en el crecimiento acelerado del tumor que observábamos”, dijo Kral, describiendo cómo el equipo se centró en AURKA y luego cartografió el circuito más amplio que involucra a MYC. Para intentar romper el bucle, los investigadores diseñaron oligonucleótidos antisentido de cambio de empalme (ASO) destinados a alterar la forma en que se empalma AURKA. El laboratorio de Krainer ha trabajado durante mucho tiempo en tecnología ASO y previamente ayudó a desarrollar nusinersen (Spinraza), un tratamiento aprobado por la FDA para la atrofia muscular espinal. En modelos celulares de PDAC, el equipo informó que el direccionamiento del empalme de AURKA produjo efectos más amplios de lo esperado: la disrupción del circuito se asoció con una reducción de la viabilidad celular y la activación de la apoptosis. “Es como matar tres pájaros de un tiro”, dijo el autor principal Adrian Krainer. “SRSF1, AURKA y MYC son todos oncogenes que contribuyen a la progresión del PDAC. Solo al dirigir el empalme de AURKA con nuestro ASO, vemos la pérdida de estas otras dos moléculas también”. El estudio, publicado en Molecular Cell (en línea el 30 de diciembre de 2025; listado en el volumen de 2026 de la revista), es una investigación en etapa temprana y no un tratamiento clínico. Los investigadores dijeron que se necesitará más trabajo para refinar el enfoque ASO antes de cualquier prueba potencial en pacientes.