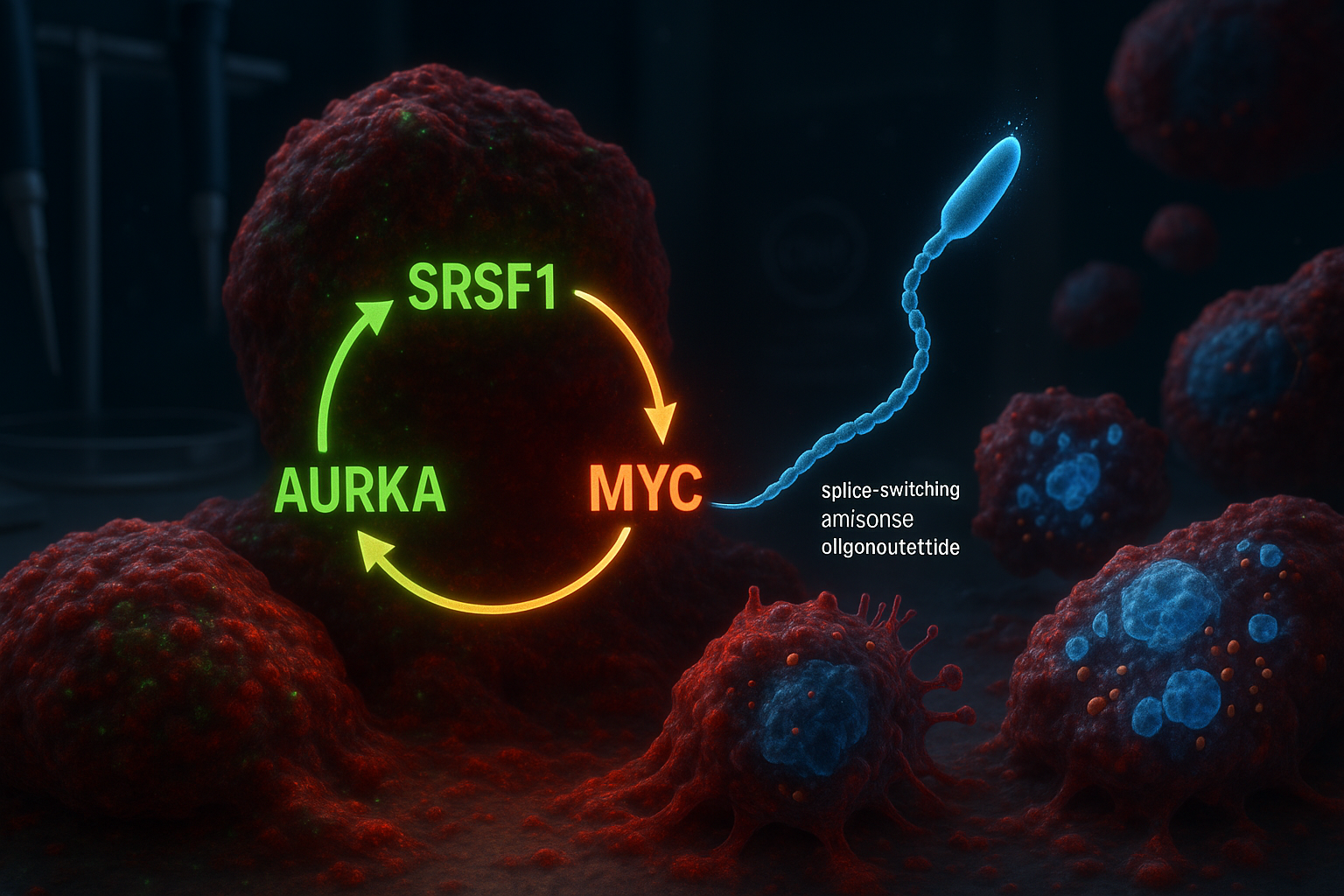
Pesquisadores do Cold Spring Harbor Laboratory relatam que identificaram um circuito molecular de três partes envolvendo SRSF1, quinase Aurora A (AURKA) e MYC que ajuda a impulsionar o adenocarcinoma ductal pancreático agressivo. Em modelos de laboratório, um oligonucléotido antisense de troca de splicing projetado para alterar o splicing de AURKA interrompeu o circuito, reduzindo a viabilidade das células tumorais e desencadeando morte celular programada.
O adenocarcinoma ductal pancreático (PDAC) é a forma mais comum e letal de câncer de pâncreas, e é notoriamente difícil de tratar. Muitas estratégias terapêuticas focaram no KRAS, um gene frequentemente mutado no PDAC, mas os tumores podem evadir tais abordagens ao longo do tempo, alimentando o interesse em alvos moleculares adicionais. Pesquisadores do Cold Spring Harbor Laboratory (CSHL) dizem que seu novo trabalho se baseia em achados anteriores do laboratório Krainer relatados em 2023, que identificaram o regulador de splicing de RNA SRSF1 como um gatilho inicial da formação de tumores PDAC. Ao reanalisar dados daquele estudo anterior, a equipe — liderada pelo ex-aluno de pós-graduação do CSHL Alexander Kral — concluiu que o SRSF1 opera em um circuito de auto-reforço com quinase Aurora A (AURKA) e o oncogene MYC. Dentro do loop proposto, o SRSF1 regula a AURKA por meio de splicing alternativo, aumentando os níveis de AURKA. A AURKA, por sua vez, ajuda a estabilizar a proteína MYC, e o MYC então impulsiona a produção de SRSF1 — reiniciando o ciclo e ajudando a impulsionar um comportamento de doença mais agressivo. “Nossa teoria era que algumas das mudanças causadas por níveis elevados de SRSF1 estavam desempenhando um papel no crescimento acelerado do tumor que observávamos”, disse Kral, descrevendo como a equipe se concentrou na AURKA e depois mapeou o circuito mais amplo envolvendo MYC. Para tentar quebrar o loop, os pesquisadores projetaram oligonucléotidos antisense de troca de splicing (ASOs) destinados a alterar como a AURKA é splicada. O laboratório Krainer trabalha há muito tempo com tecnologia ASO e anteriormente ajudou a desenvolver nusinersen (Spinraza), um tratamento aprovado pela FDA para atrofia muscular espinhal. Em modelos celulares de PDAC, a equipe relatou que o direcionamento ao splicing de AURKA produziu efeitos mais amplos do que o esperado: a interrupção do circuito foi associada à redução da viabilidade celular e à ativação da apoptose. “É como matar três pássaros com uma pedra só”, disse o autor sênior Adrian Krainer. “SRSF1, AURKA e MYC são todos oncogenes que contribuem para a progressão do PDAC. Apenas direcionando o splicing de AURKA com nosso ASO, vemos a perda desses outros dois também.” O estudo, publicado em Molecular Cell (online em 30 de dezembro de 2025; listado no volume de 2026 da revista), é pesquisa em estágio inicial e não um tratamento clínico. Os pesquisadores disseram que mais trabalho será necessário para refinar a abordagem ASO antes de qualquer teste potencial em pacientes.