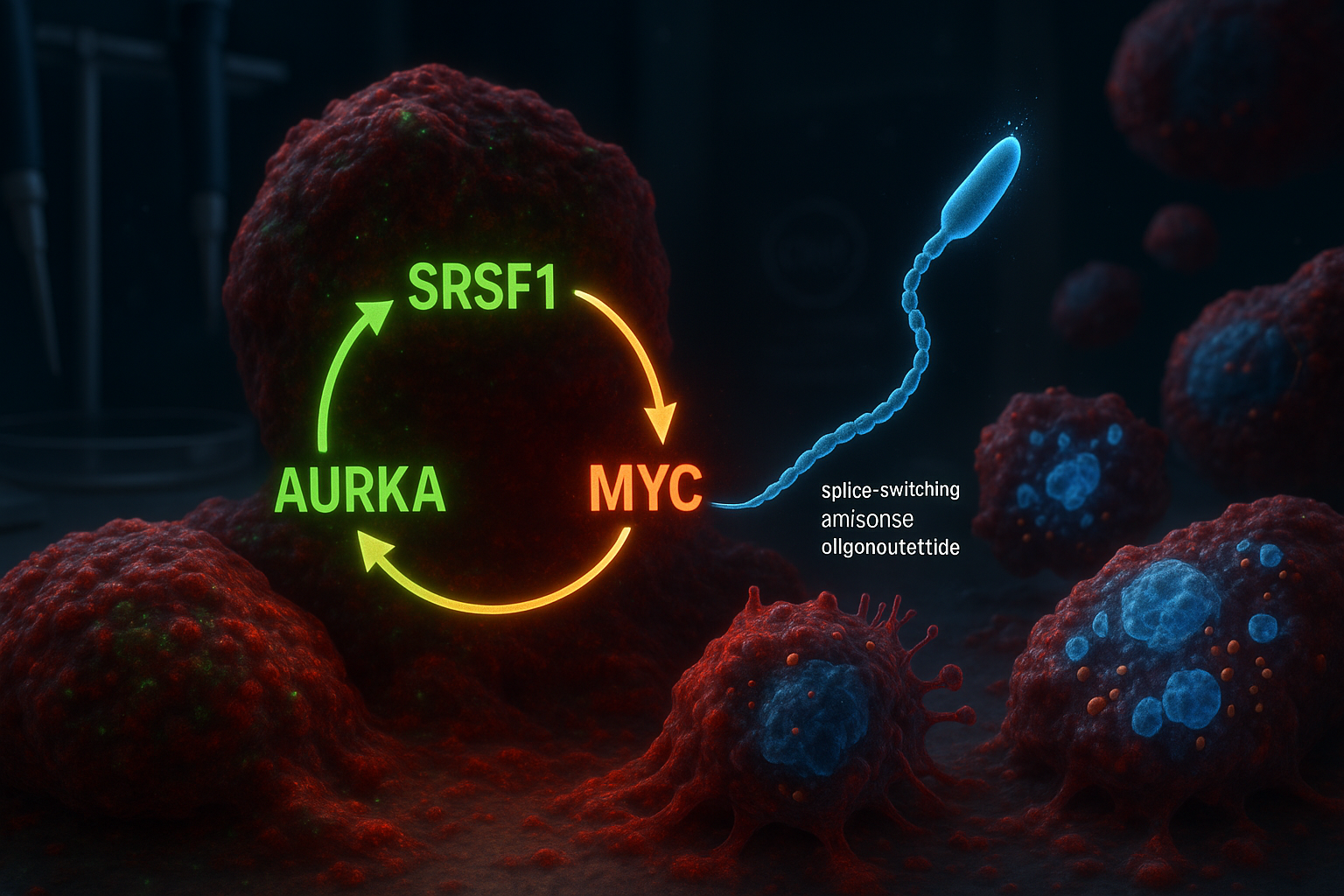
Forskare vid Cold Spring Harbor Laboratory rapporterar att de identifierat en tre-delad molekylär krets som involverar SRSF1, Aurora kinas A (AURKA) och MYC som driver aggressiv pankreasductal adenocarcinom. I laboratoriemodeller bröt en spliceväxlande antisense-oligonukleotid designad för att ändra AURKA-splicing kretsen, minskade tumörcelltvivabilitet och utlöste programmerad celldöd.
Pankreasductal adenocarcinom (PDAC) är den vanligaste och dödligaste formen av pankreascancer och är ökänd för att vara svår att behandla. Många terapeutiska strategier har fokuserat på KRAS, en ofta muterad gen i PDAC, men tumörer kan kringgå sådana metoder över tid, vilket väcker intresse för ytterligare molekylära mål. Forskare vid Cold Spring Harbor Laboratory (CSHL) säger att deras nya arbete bygger på tidigare fynd från Krainer-labbet rapporterade 2023, som identifierade RNA-splicingregulatorn SRSF1 som en tidig utlösare för PDAC-tumörbildning. Genom att omanalysera data från den tidigare studien drog teamet — lett av tidigare CSHL-doktorand Alexander Kral — slutsatsen att SRSF1 fungerar i en självförstärkande krets med Aurora kinas A (AURKA) och onkogenen MYC. Inom den föreslagna loopen reglerar SRSF1 AURKA via alternativ splicing, vilket ökar AURKA-nivåer. AURKA stabiliserar i sin tur MYC-proteinet, och MYC ökar sedan produktionen av SRSF1 — startar cykeln igen och driver mer aggressivt sjukdomsbeteende. ”Vår teori var att vissa förändringar orsakade av ökade nivåer av SRSF1 spelade en roll i den accelererade tumörtillväxten vi såg”, sa Kral och beskrev hur teamet fokuserade på AURKA och sedan kartlade den bredare kretsen med MYC. För att försöka bryta loopen designade forskarna spliceväxlande antisense-oligonukleotider (ASO) avsedda att ändra hur AURKA splicas. Krainer-labbet har länge arbetat med ASO-teknik och tidigare bidragit till nusinersen (Spinraza), en FDA-godkänd behandling för spinal muskelatrofi. I PDAC-cellmodeller rapporterade teamet att targeting av AURKA-splicing gav bredare effekter än väntat: kretsbrott associerades med minskad cellviabilitet och aktivering av apoptos. ”Det är som att slå tre flugor i en smäll”, sa seniorförfattaren Adrian Krainer. ”SRSF1, AURKA och MYC är alla onkogener som bidrar till PDAC-progression. Bara genom att rikta AURKA-splicing med vår ASO ser vi förlust av dessa två andra molekyler också.” Studien, publicerad i Molecular Cell (online 30 december 2025; listad i tidskriftens 2026-volym), är tidig forskning och inte en klinisk behandling. Forskarna sa att ytterligare arbete behövs för att förfina ASO-metoden innan eventuella tester på patienter.