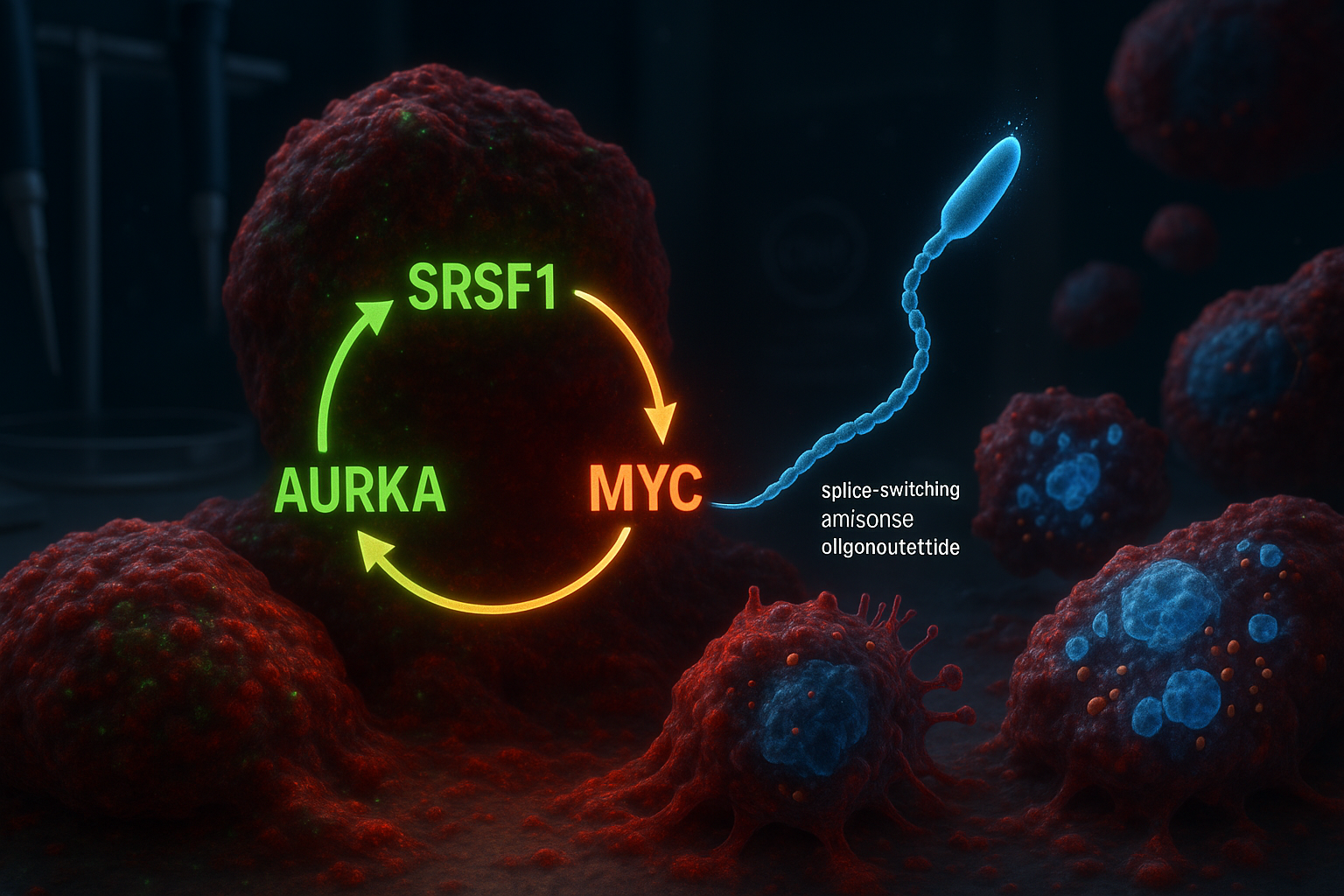
Peneliti di Cold Spring Harbor Laboratory melaporkan bahwa mereka telah mengidentifikasi sirkuit molekuler tiga bagian yang melibatkan SRSF1, Aurora kinase A (AURKA), dan MYC yang membantu mendorong adenocarcinoma duktal pankreas agresif. Dalam model laboratorium, olgonukleotida antisense pengalih sambungan yang dirancang untuk mengubah penyambungan AURKA mengganggu sirkuit tersebut, mengurangi viabilitas sel tumor dan memicu kematian sel terprogram.
Adenokarsinoma duktal pankreas (PDAC) adalah bentuk kanker pankreas yang paling umum dan paling mematikan, dan sangat sulit diobati. Banyak strategi terapeutik telah berfokus pada KRAS, gen yang sering dimutasi pada PDAC, tetapi tumor dapat menghindari pendekatan tersebut seiring waktu, yang memicu minat pada target molekuler tambahan. Peneliti Cold Spring Harbor Laboratory (CSHL) mengatakan bahwa penelitian baru mereka membangun temuan sebelumnya dari lab Krainer yang dilaporkan pada 2023, yang mengidentifikasi pengatur penyambungan RNA SRSF1 sebagai pemicu awal pembentukan tumor PDAC. Dengan menganalisis ulang data dari studi sebelumnya tersebut, tim—dipimpin oleh mantan mahasiswa pascasarjana CSHL Alexander Kral—menyimpulkan bahwa SRSF1 beroperasi dalam sirkuit penguat diri dengan Aurora kinase A (AURKA) dan onkogen MYC. Dalam loop yang diusulkan, SRSF1 mengatur AURKA melalui penyambungan alternatif, meningkatkan level AURKA. AURKA pada gilirannya membantu menstabilkan protein MYC, dan MYC kemudian meningkatkan produksi SRSF1—memulai kembali siklus dan membantu mendorong perilaku penyakit yang lebih agresif. “Teori kami adalah bahwa beberapa perubahan yang disebabkan oleh peningkatan level SRSF1 memainkan peran dalam pertumbuhan tumor yang dipercepat yang kami amati,” kata Kral, menjelaskan bagaimana tim fokus pada AURKA dan kemudian memetakan sirkuit yang lebih luas yang melibatkan MYC. Untuk mencoba memecah loop tersebut, para peneliti merancang olgonukleotida antisense pengalih sambungan (ASO) yang dimaksudkan untuk mengubah cara AURKA disambung. Lab Krainer telah lama bekerja pada teknologi ASO dan sebelumnya membantu mengembangkan nusinersen (Spinraza), pengobatan yang disetujui FDA untuk atrofi otot spinal. Dalam model sel PDAC, tim melaporkan bahwa menargetkan penyambungan AURKA menghasilkan efek yang lebih luas dari yang diharapkan: mengganggu sirkuit dikaitkan dengan penurunan viabilitas sel dan aktivasi apoptosis. “Seperti membunuh tiga burung dengan satu batu,” kata penulis senior Adrian Krainer. “SRSF1, AURKA, dan MYC semuanya adalah onkogen yang berkontribusi pada progresi PDAC. Hanya dengan menargetkan penyambungan AURKA dengan ASO kami, kami melihat hilangnya dua molekul lainnya juga.” Studi tersebut, yang diterbitkan di Molecular Cell (online 30 Desember 2025; terdaftar dalam volume jurnal 2026), adalah penelitian tahap awal dan bukan pengobatan klinis. Para peneliti mengatakan bahwa pekerjaan lebih lanjut akan diperlukan untuk menyempurnakan pendekatan ASO sebelum pengujian potensial pada pasien.