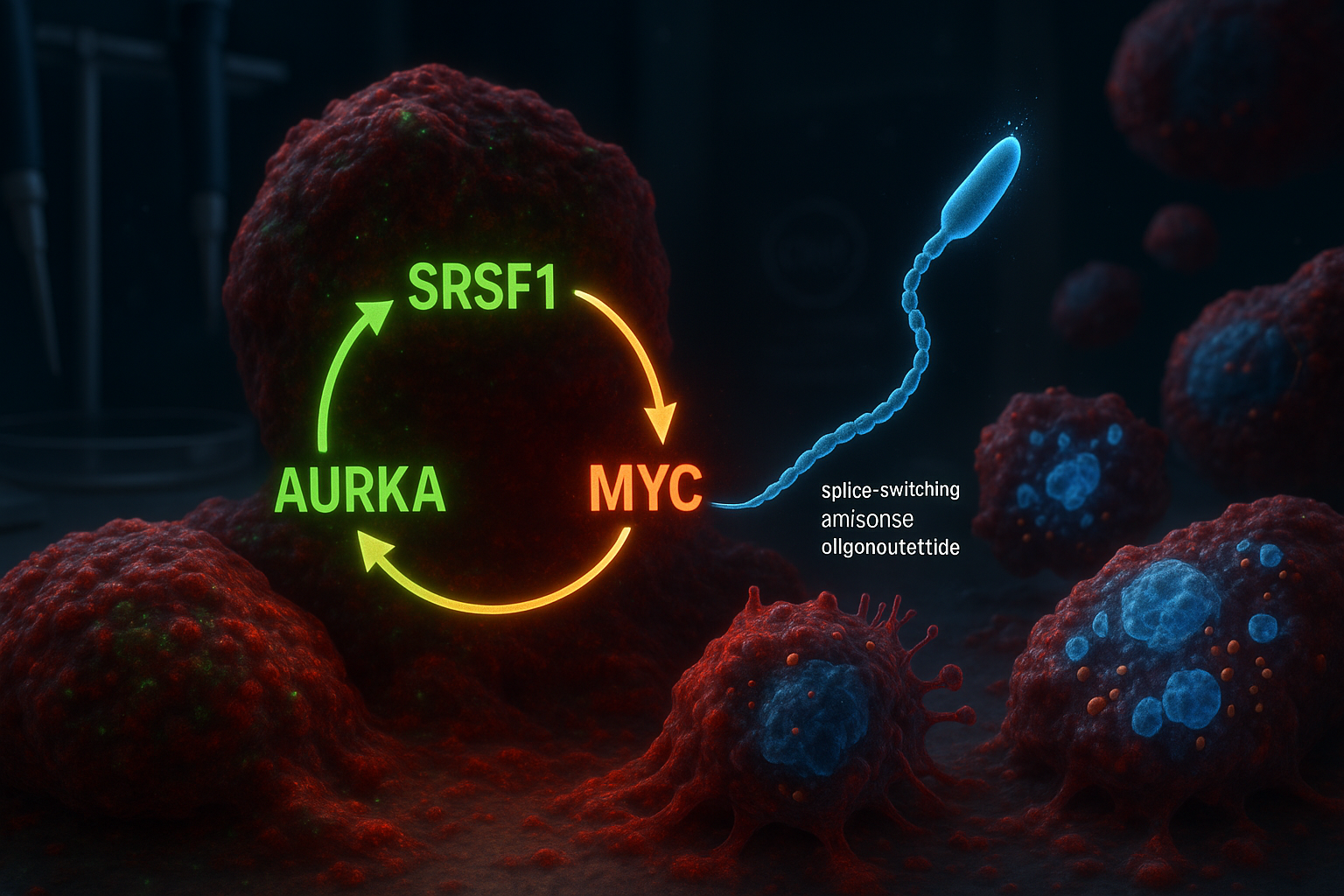
Cold Spring Harbor Laboratoryの研究者らが、SRSF1、オーロラキナーゼA(AURKA)、MYCを介した3要素の分子回路を同定し、これが攻撃的な膵管腺がんを駆動することを報告。実験室モデルでは、AURKAのスプライシングを変化させるスプライススイッチングアンチセンスオリゴヌクレオチド(ASO)がこの回路を阻害し、腫瘍細胞の生存性を低下させ、プログラム細胞死を誘導した。
膵管腺がん(PDAC)は、膵臓がんの最も一般的な形態であり、最も致死性が高く、治療が極めて困難である。多くの治療戦略はPDACで頻繁に変異するKRASに焦点を当ててきたが、腫瘍は時間とともにこれらのアプローチを回避し得るため、追加の分子標的への関心が高まっている。Cold Spring Harbor Laboratory(CSHL)の研究者らは、新たな研究が2023年にKrainer研究室で報告された先行研究に基づいていると述べている。同研究では、RNAスプライシング調節因子SRSF1がPDAC腫瘍形成の初期トリガーとして同定された。過去の研究データを再解析したチーム——元CSHL大学院生Alexander Kralが主導——は、SRSF1がオーロラキナーゼA(AURKA)とオンコジンMYCとの自己強化回路で機能することを結論づけた。この提案されたループ内では、SRSF1が代替スプライシングを介してAURKAを調節し、AURKAレベルを増加させる。AURKAは逆にMYCタンパク質を安定化し、MYCはSRSF1の産生を促進——サイクルを再開し、より攻撃的な疾患行動を駆動する。「SRSF1レベルの上昇が引き起こす変化の一部が、観察された腫瘍成長の加速に関与しているというのが我々の仮説だった」とKralは述べ、チームがAURKAに焦点を当て、MYCを含む広範な回路をマッピングした経緯を説明した。ループを断ち切るため、研究者らはAURKAのスプライシングを変化させるスプライススイッチングASOを設計した。Krainer研究室は長年ASO技術に取り組み、脊髄性筋萎縮症のFDA承認治療nusinersen(Spinraza)の開発にも貢献した。PDAC細胞モデルでは、AURKAスプライシングの標的化は予想以上の広範な効果を示した:回路の阻害は細胞生存性の低下とアポトーシス活性化と関連した。「一石三鳥を殺すようなものだ」と主任著者のAdrian Krainerは述べた。「SRSF1、AURKA、MYCはすべてPDAC進行に寄与するオンコジンである。我々のASOでAURKAスプライシングを標的化するだけで、これら他の2分子も失われる」。この研究はM*o*l*e*c*u*l*a*r C*e*l*lに掲載(2025年12月30日オンライン;2026年巻に記載)され、初期段階の研究であり臨床治療ではない。研究者らは、患者での潜在的試験前にASOアプローチを洗練するためのさらなる研究が必要だと述べた。