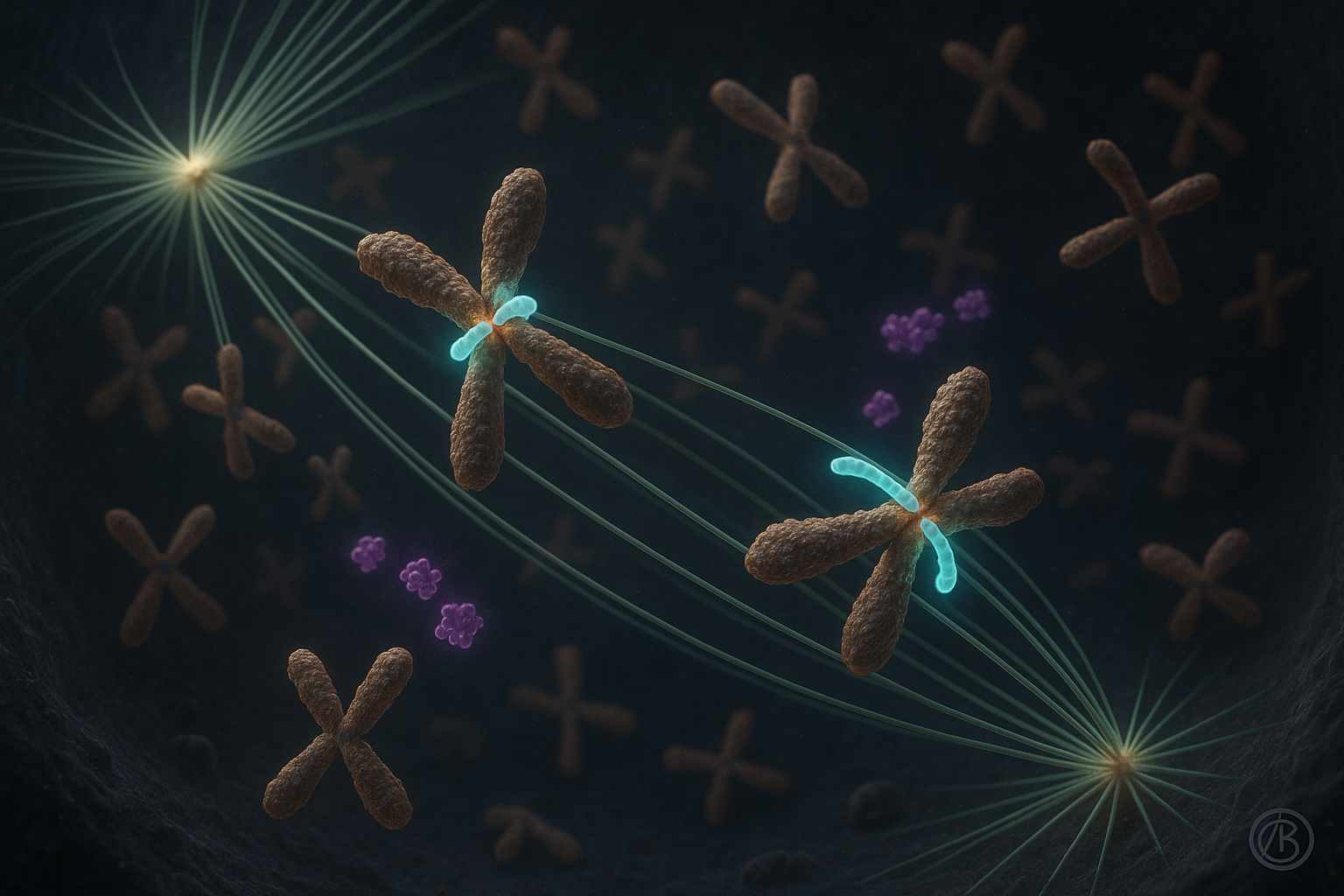
Forskare vid Ruđer Bošković-institutet i Zagreb rapporterar att proteinet CENP-E spelar en avgörande roll i att stabilisera de tidigaste fästena mellan kromosomer och mikrotubuli under celldelning, snarare än att främst fungera som en motor som drar kromosomer på plats. Arbetet, beskrivet i två studier i Nature Communications, reviderar långvariga modeller för kromosomkongress genom att koppla CENP-E:s funktion till Aurora-kinaser och föreslå implikationer för förståelsen av sjukdomar präglade av kromosomsegregationsfel.
Celldelning kräver exakt kromosomupplinering så att varje dottercell får en korrekt kopia av det genetiska materialet. Fel i denna process kan leda till oförmåga att få barn, utvecklingsstörningar och cancer, en koppling som är väldokumenterad i cellbiologisk forskning.
I nästan två decennier har den dominerande modellen hävdat att CENP-E, ett kinetokor-motorprotein, transporterade felupplinjerade kromosomer mot cellens spindelcentrum huvudsakligen genom att glida dem längs mikrotubuli. Nyligen arbete av ett team ledd av Dr. Kruno Vukušić och professor Iva M. Tolić vid Ruđer Bošković-institutet utmanar denna syn.
I en av de nya Nature Communications-artiklarna rapporterar författarna att CENP-E är essentiell för att initiera kromosomkongress genom att främja och stabilisera end-on-fästen mellan kinetokorer och mikrotubuli, särskilt för kromosomer som börjar nära spindelpolerna. När dessa stabila fästen bildas och biorientering etableras fortskrider den efterföljande rörelsen av kromosomer mot spindelns ekvator med liknande dynamik oavsett CENP-E-aktivitet, enligt studien.
Forskningen visar vidare att Aurora A- och Aurora B-kinaser verkar som hämmare av detta initieringssteg när CENP-E är frånvarande eller inaktiv, delvis genom att driva hyperfosforylering av mikrotubuli-bindande proteiner och upprätthålla en utvidgad fibrös corona vid kinetoker. CENP-E motverkar Aurora B-medierad fosforylering på ett BubR1-beroende sätt, vilket hjälper till att stabilisera initiala end-on-fästen och utlösa övergången från lateralt till end-on-bindning.
En kompletterande Nature Communications-artikel från samma grupp utökar denna bild genom att föreslå en återkopplingsloop mellan centrosomer och kinetokorer där Aurora A-aktivitet nära spindelpoler förstärker Aurora B vid kinetokorer, vilket begränsar starten av kongress när CENP-E inte är funktionell. Att ta bort centrioler eller hämma Aurora A lättar detta broms och kan tillåta kongress att börja även utan aktiv CENP-E, rapporterar författarna.
Tillsammans antyder studierna att kromosomkongress vecklas ut i minst två biomekaniska faser: en initieringsfas som starkt beror på CENP-E:s förmåga att stabilisera end-on-fästen inför Aurora-kinasaktivitet, och en efterföljande rörelsefas dominerad av spindelageometri och mikrotubuli-dynamik snarare än CENP-E-driven transport.
Resultaten reviderar en kraftfokuserad beskrivning som förekommit i läroboksmodeller av mitos, och ersätter den med ett regulatoriskt ramverk där CENP-E, Aurora-kinaser, BubR1 och andra kinetoker-komponenter koordinerar tidpunkten och platsen för stabila mikrotubuli-fästen. Enligt en sammanfattning från Ruđer Bošković-institutet hjälper arbetet, genom att klargöra hur dessa molekylära regulatorer samverkar, att förklara hur celler upprätthåller hög trohet under delning och kan informera framtida forskning om cancer och andra tillstånd där kromosomsegregation ofta störs.
Båda studierna utfördes vid Ruđer Bošković-institutet och stöddes av Europeiska forskningsrådets bidrag och nationell kroatisk finansiering, och de byggde på avancerad live-cell-bildtagning och beräkningsanalys för att spåra kromosombeteende och molekylär signalering under mitos.