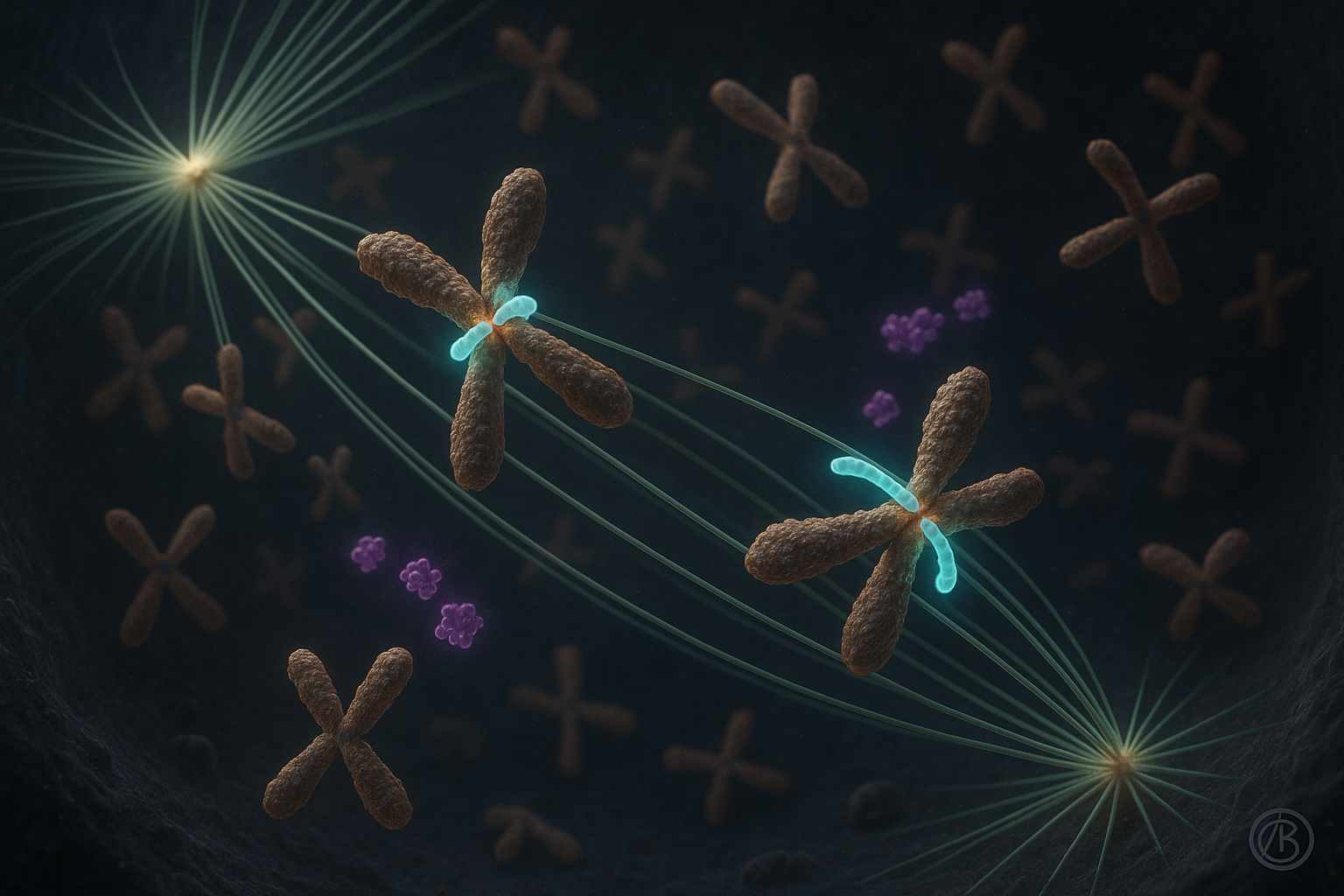
يبلغ باحثون في معهد روذر بوشكوفيتش في زغرب أن البروتين CENP-E يلعب دورًا حاسمًا في تثبيت الروابط الأولى بين الكروموسومات والميكروتوبيولات أثناء انقسام الخلية، بدلاً من أن يعمل بشكل أساسي كمحرك يسحب الكروموسومات إلى مكانها. العمل، الموصوف في دراستين في Nature Communications، يعدل نماذج طويلة الأمد لتجمع الكروموسومات بربط وظيفة CENP-E بإنزيمات الأورورا كيناز ويقترح آثارًا لفهم الأمراض المميزة بأخطاء في فصل الكروموسومات.
يتطلب انقسام الخلية محاذاة دقيقة للكروموسومات حتى تتلقى كل خلية ابنة نسخة دقيقة من المادة الوراثية. يمكن أن تؤدي الأخطاء في هذه العملية إلى العقم وعيوب النمو والسرطان، وهي علاقة موثقة على نطاق واسع في أبحاث بيولوجيا الخلية.
لمدة نحو عقدين، كان النموذج السائد يفترض أن CENP-E، بروتين حركي للكينيتوكور، ينقل الكروموسومات غير المحاذاة نحو مركز غربال الخلية بشكل كبير عن طريق الانزلاق عليها على طول الميكروتوبيولات. عمل حديث لفريق بقيادة الدكتور كرونو فوكوشيتش والأستاذة إيفا إم. توليتش في معهد روذر بوشكوفيتش يتحدى هذا الرأي.
في إحدى أوراق Nature Communications الجديدة، يبلغ المؤلفون أن CENP-E أساسي لبدء تجمع الكروموسومات من خلال تعزيز وتثبيت الروابط end-on بين الكينيتوكورات والميكروتوبيولات، خاصة للكروموسومات التي تبدأ بالقرب من أقطاب الغربال. بمجرد تشكل هذه الروابط المستقرة وإقامة التوجيه المزدوج، يتقدم الحركة اللاحقة للكروموسومات نحو خط الاستواء الغربالي بديناميكيات مشابهة بغض النظر عن نشاط CENP-E، وفقًا للدراسة.
تظهر البحوث أيضًا أن إنزيمات الأورورا A و الأورورا B تعمل كمثبطات لهذه الخطوة الأولية عند غياب CENP-E أو عدم نشاطها، جزئيًا عن طريق دفع الفرط في الفسفرة للبروتينات المرتبطة بالميكروتوبيولات والحفاظ على هالة ليفية موسعة في الكينيتوكورات. يقاوم CENP-E الفسفرة الوسيطة بأورورا B بطريقة تعتمد على BubR1، مما يساعد في تثبيت الروابط end-on الأولية وإطلاق الانتقال من الارتباط الجانبي إلى end-on.
مقالة مصاحبة في Nature Communications من نفس المجموعة توسع هذه الصورة باقتراح حلقة تغذية راجعة بين السنتروسومات والكينيتوكورات حيث تعزز نشاط أورورا A بالقرب من أقطاب الغربال أورورا B في الكينيتوكورات، مما يحد من بداية التجمع عندما لا تكون CENP-E وظيفية. إزالة السنتريولات أو تثبيط أورورا A يخفف هذا الفرامل ويمكن أن يسمح ببدء التجمع حتى بدون CENP-E نشطة، يبلغ المؤلفون.
معًا، تقترح الدراسات أن تجمع الكروموسومات يتكشف في مرحلتين بيوميكانيكيتين على الأقل: مرحلة بداية تعتمد بقوة على قدرة CENP-E على تثبيت الروابط end-on في وجه نشاط إنزيم الأورورا كيناز، ومرحلة حركة لاحقة تهيمن عليها هندسة الغربال وديناميكيات الميكروتوبيولات بدلاً من النقل المدفوع بـCENP-E.
تعيد النتائج صياغة وصف يركز على القوة ظهر في نماذج كتب المدرسة للانقسام المتساوي، مستبدلة إياه بإطار تنظيمي ينسق فيه CENP-E وإنزيمات الأورورا وBubR1 ومكونات الكينيتوكور الأخرى توقيت وموقع الروابط المستقرة بالميكروتوبيولات. وفقًا لملخص من معهد روذر بوشكوفيتش، من خلال توضيح كيفية تعاون هذه المنظمات الجزيئية، يساعد العمل في شرح كيف تحافظ الخلايا على دقة عالية أثناء الانقسام وقد يساهم في أبحاث مستقبلية حول السرطانات وغيرها من الحالات حيث يتعطل فصل الكروموسومات بشكل متكرر.
تم إجراء كلا الدراستين في معهد روذر بوشكوفيتش ودعمتها منح من المجلس الأوروبي للبحث والتمويل الوطني الكرواتي، واعتمدتا على تصوير خلايا حية متقدم وتحليل حاسوبي لتتبع سلوك الكروموسومات وإشارات الجزيئات أثناء الانقسام المتساوي.