ザグレブのルジェル・ボシュコビッチ研究所の研究者らは、CENP-Eタンパク質が細胞分裂中に染色体と微小管の最初の付着を安定化させる上で重要な役割を果たすと報告し、主に染色体をその位置に引き寄せるモーターとして機能するのではなく、この仕事はNature Communicationsに掲載された2つの研究で記述され、CENP-Eの機能をAuroraキナーゼと関連づけ、染色体分離エラーを特徴とする疾患の理解に示唆を与えることで、長年の染色体コンプレッション・モデルを修正する。
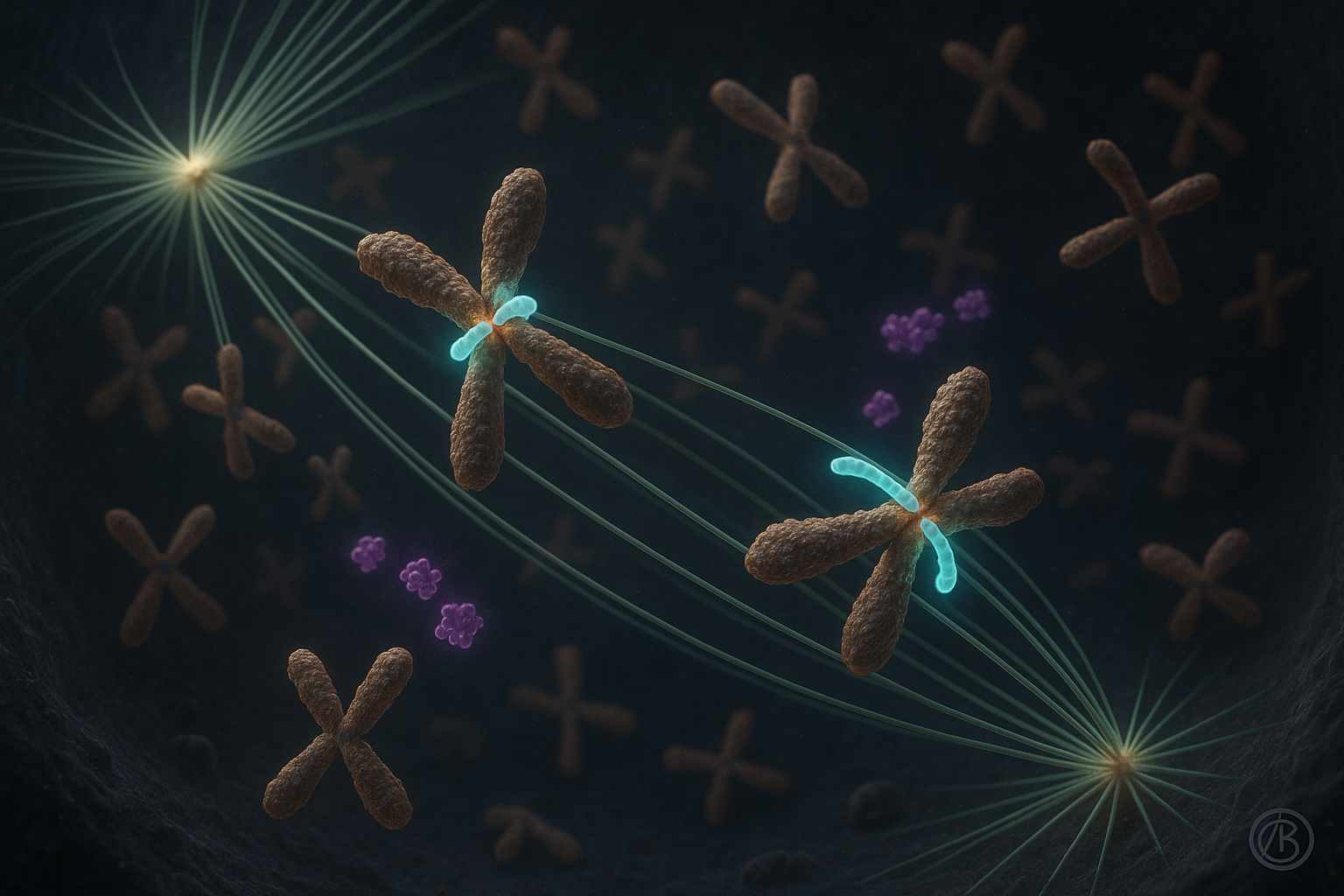
細胞分裂では、各娘細胞が遺伝物質の正確なコピーを受けるために染色体の精密な整列が必要である。このプロセスにおけるエラーは、不妊、発達障害、がんを引き起こす可能性があり、細胞生物学研究で広く文書化されている。
ほぼ2十年間、主たるモデルでは、キネトコア・モータープロテインであるCENP-Eが、微小管に沿って誤整列染色体を滑らせ、主に細胞紡錘の中心へ運ぶとされていた。ルジェル・ボシュコビッチ研究所のKruno Vukušić博士とIva M. Tolić教授率いるチームの最近の研究がこの見方を覆す。
新しいNature Communications論文の1つで、著者らはCENP-Eが、特に紡錘極近くから始まる染色体において、キネトコアと微小管間のend-on付着を促進・安定化することで染色体コンプレッションを開始するのに不可欠であると報告した。これらの安定付着が形成され、バイオリエンテーションが確立されると、CENP-E活性の有無にかかわらず、染色体の紡錘赤道への後続移動は類似のダイナミクスで進行すると研究は述べる。
研究はさらに、CENP-E不在または不活性時、Aurora AおよびAurora Bキナーゼがこの開始ステップを阻害し、微小管結合タンパク質の過剰リン酸化を駆動し、キネトコアでの拡張した繊維性コロナを維持することでその一部を担うことを示す。CENP-EはBubR1依存的にAurora B媒介リン酸化に対抗し、初期end-on付着を安定化し、側方からend-on結合への移行を誘発する。
同じグループからのNature Communicationsの補足記事は、紡錘極近くのAurora A活性がキネトコアでのAurora Bを強化するセントロソームとキネトコア間のフィードバックループを提案し、CENP-Eが機能しない場合のコンプレッション開始を制限することを拡張する。中心粒を除去またはAurora Aを阻害すると、このブレーキが緩み、活性CENP-Eなしでもコンプレッションを開始できると著者らは報告。
これらの研究は、染色体コンプレッションが少なくとも2つのバイオメカニクス段階で展開することを示唆する:Auroraキナーゼ活性に直面したCENP-Eのend-on付着安定化能力に強く依存する開始段階と、CENP-E駆動輸送ではなく紡錘ジオメトリと微小管ダイナミクスが支配する後続移動段階。
これらの知見は、有糸分裂の教科書モデルに現れた力中心の記述を修正し、CENP-E、Auroraキナーゼ、BubR1、および他のキネトコア成分が安定微小管付着のタイミングと位置を調整する規制フレームワークに置き換える。ルジェル・ボシュコビッチ研究所の要約によると、これら分子レギュレータの協調を明らかにすることで、細胞が分裂中の高忠実度を維持する方法を説明し、染色体分離が頻繁に乱れるがんや他の疾患に関する将来研究に寄与する可能性がある。
両研究はルジェル・ボシュコビッチ研究所で行われ、欧州研究評議会助成金とクロアチア国家資金で支援され、高度なライブセルイメージングと計算解析により、有糸分裂中の染色体挙動と分子シグナリングを追跡した。