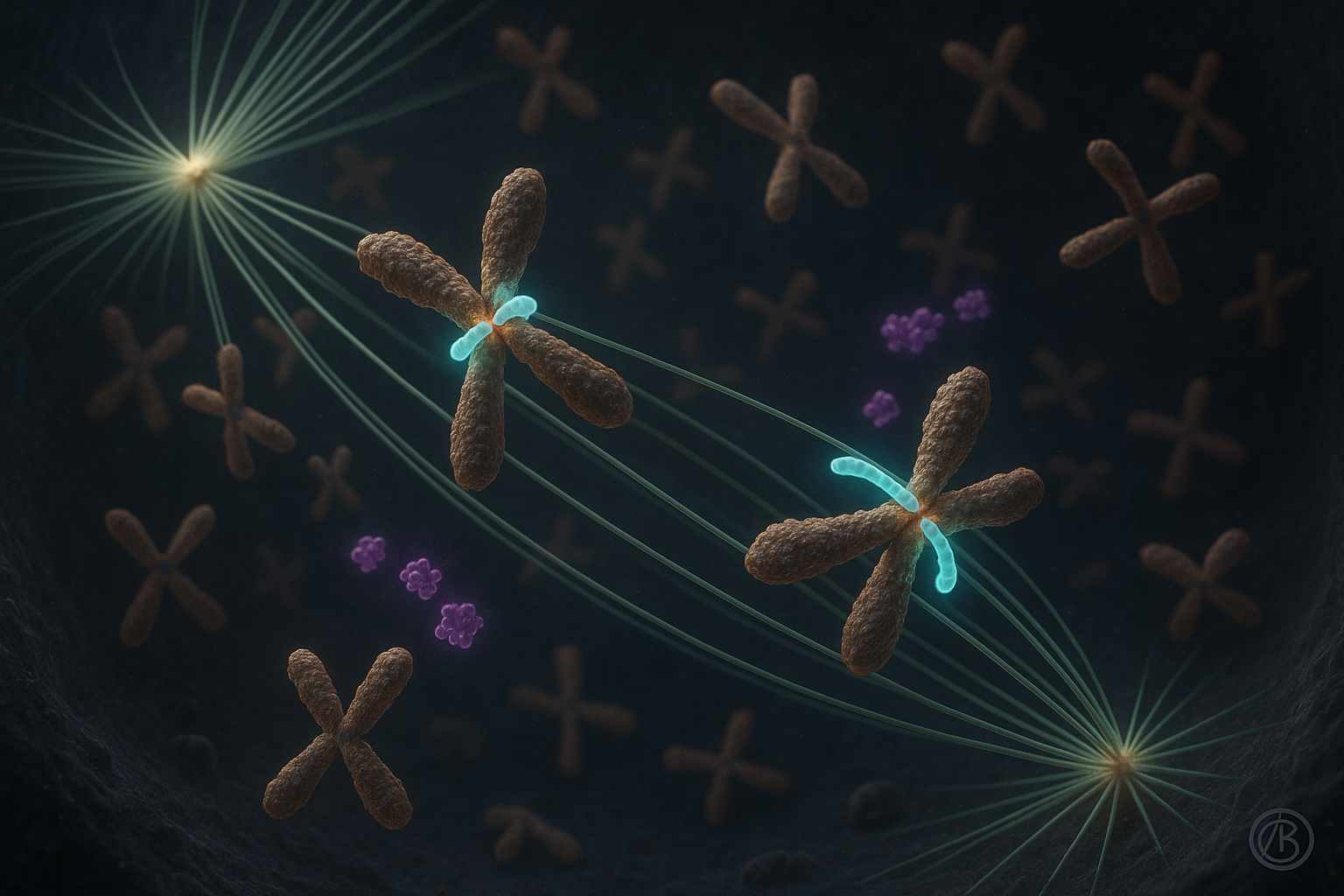
Investigadores del Instituto Ruđer Bošković en Zagreb informan que la proteína CENP-E juega un papel crucial en la estabilización de los primeros enlaces entre cromosomas y microtúbulos durante la división celular, en lugar de actuar principalmente como un motor que arrastra los cromosomas a su posición. El trabajo, descrito en dos estudios en Nature Communications, revisa modelos tradicionales de congreso cromosómico al vincular la función de CENP-E con las quinasa Aurora e insinuar implicaciones para entender enfermedades marcadas por errores en la segregación cromosómica.
La división celular requiere una alineación precisa de los cromosomas para que cada célula hija reciba una copia exacta del material genético. Errores en este proceso pueden llevar a infertilidad, trastornos del desarrollo y cáncer, una conexión ampliamente documentada en la investigación de biología celular.
Durante casi dos décadas, el modelo dominante sostenía que CENP-E, una proteína motora del cinetocoro, transportaba cromosomas mal alineados hacia el centro del huso celular principalmente deslizándolos a lo largo de los microtúbulos. Un trabajo reciente de un equipo liderado por el Dr. Kruno Vukušić y la profesora Iva M. Tolić en el Instituto Ruđer Bošković desafía esta visión.
En uno de los nuevos artículos de Nature Communications, los autores informan que CENP-E es esencial para iniciar el congreso cromosómico al promover y estabilizar enlaces end-on entre cinetocoros y microtúbulos, especialmente para cromosomas que comienzan cerca de los polos del huso. Una vez que se forman estos enlaces estables y se establece la biorientación, el movimiento subsiguiente de los cromosomas hacia el ecuador del huso procede con dinámicas similares independientemente de la actividad de CENP-E, según el estudio.
La investigación muestra además que las quinasa Aurora A y Aurora B actúan como inhibidoras de este paso inicial cuando CENP-E está ausente o inactiva, en parte impulsando la hiperfosforilación de proteínas de unión a microtúbulos y manteniendo una corona fibrosa expandida en los cinetocoros. CENP-E contrarresta la fosforilación mediada por Aurora B de manera dependiente de BubR1, ayudando a estabilizar los enlaces end-on iniciales y desencadenar la transición de unión lateral a end-on.
Un artículo complementario de Nature Communications del mismo grupo amplía esta imagen proponiendo un bucle de retroalimentación entre centrómeros y cinetocoros en el que la actividad de Aurora A cerca de los polos del huso potencia Aurora B en los cinetocoros, limitando así el inicio del congreso cuando CENP-E no es funcional. Eliminar centriolos o inhibir Aurora A relaja este freno y puede permitir que el congreso comience incluso sin CENP-E activa, informan los autores.
En conjunto, los estudios sugieren que el congreso cromosómico se desarrolla en al menos dos fases biomecánicas: una fase de iniciación que depende fuertemente de la capacidad de CENP-E para estabilizar enlaces end-on frente a la actividad de las quinasa Aurora, y una fase de movimiento subsiguiente dominada por la geometría del huso y la dinámica de los microtúbulos en lugar del transporte impulsado por CENP-E.
Los hallazgos revisan una descripción centrada en la fuerza que ha aparecido en modelos de libro de texto de la mitosis, reemplazándola con un marco regulatorio en el que CENP-E, las quinasa Aurora, BubR1 y otros componentes del cinetocoro coordinan el momento y la ubicación de los enlaces estables a microtúbulos. Según un resumen del Instituto Ruđer Bošković, al aclarar cómo cooperan estos reguladores moleculares, el trabajo ayuda a explicar cómo las células mantienen una alta fidelidad durante la división y puede informar investigaciones futuras sobre cánceres y otras condiciones donde la segregación cromosómica se interrumpe frecuentemente.
Ambos estudios se llevaron a cabo en el Instituto Ruđer Bošković y fueron apoyados por subvenciones del Consejo Europeo de Investigación y fondos nacionales croatas, y se basaron en imagen avanzada de células vivas y análisis computacional para rastrear el comportamiento de los cromosomas y la señalización molecular durante la mitosis.