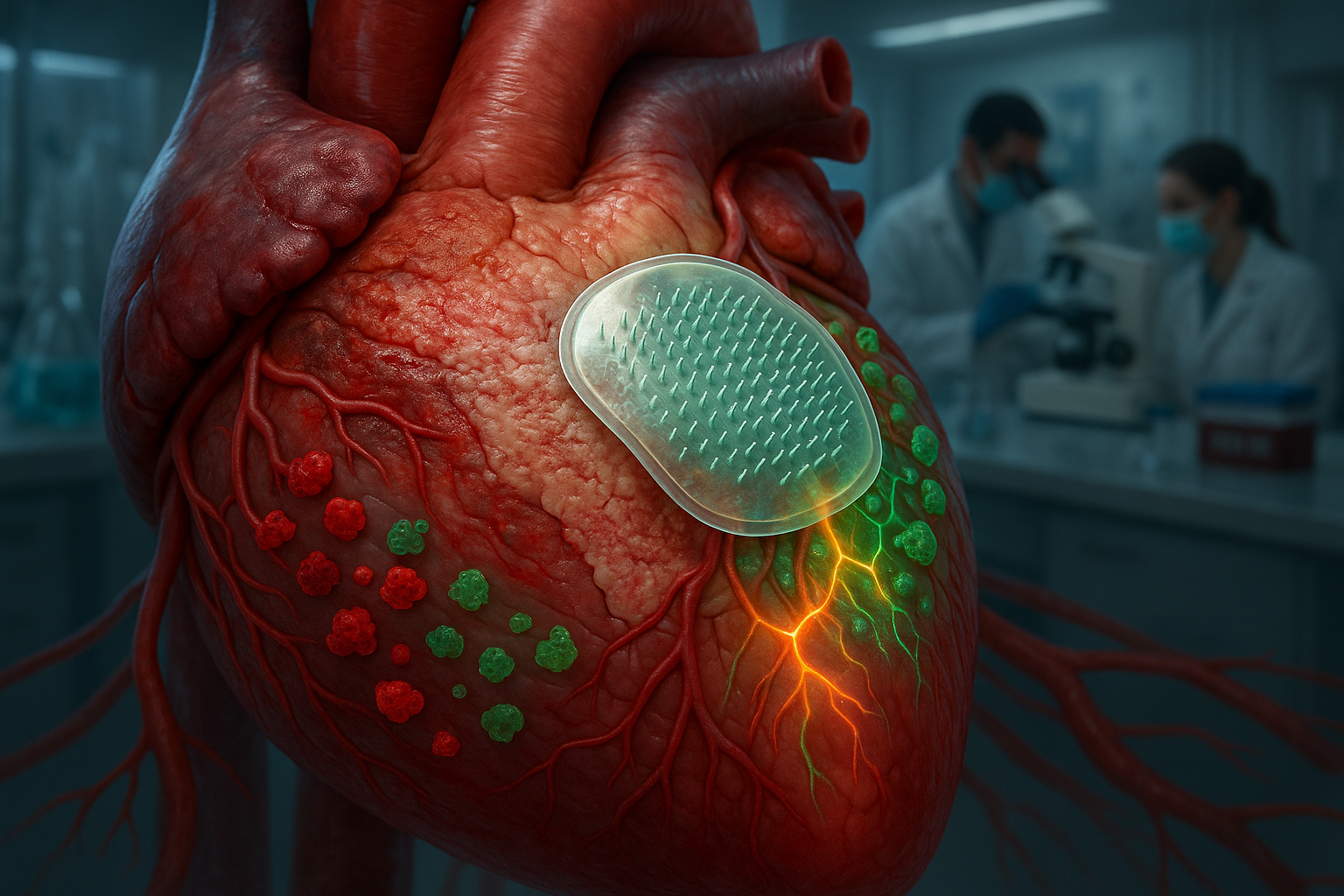
طوّر فريق من جامعة تكساس إيه آند إم لصقة قابلة للتحلل البيولوجي من الإبر الدقيقة التي توصل الإنترلوكين-4 مباشرة إلى نسيج القلب التالف بعد نوبة قلبية. في النماذج قبل السريرية، يحول هذا النهج المستهدف الخلايا المناعية إلى وضع الشفاء ويحسن التواصل بين خلايا عضلة القلب وخلايا الأوعية الدموية، مع تجنب العديد من الآثار الجانبية المرئية مع التوصيل الدوائي الجهازي.
تحرم نوبات القلب خلايا عضلة القلب من الأكسجين والمغذيات، مما يؤدي إلى موت الخلايا وتكوّن نسيج الندبة. بينما تساعد هذه الندبة في تثبيت المنطقة التالفة، إلا أنها لا تستطيع الانقباض مثل العضلة الصحية، مما يجبر النسيج القلبي المتبقي على العمل بجهد أكبر وقد يساهم في فشل القلب على المدى الطويل.
لمعالجة ذلك، أنشأ فريق بقيادة الدكتور كي هوانغ في جامعة تكساس إيه آند إم لصقة قابلة للتحلل البيولوجي من الإبر الدقيقة التي توصل الإنترلوكين-4 (IL-4)، وهي جزيء معروف بتنظيم الاستجابات المناعية، مباشرة إلى نسيج القلب المصاب. تحتوي كل إبرة دقيقة في اللصقة على جزيئات مجهرية محملة بـIL-4. عند تطبيق اللصقة على سطح القلب، تخترق الإبر الدقيقة الطبقة الخارجية وتذوب، مما يطلق الدواء في العضلة التالفة تحته، وفقًا لبيان جامعة تكساس إيه آند إم.
من خلال تركيز IL-4 في موقع الإصابة، تشجع اللصقة الخلايا البلعمية —الخلايا المناعية الرئيسية— على التحول من حالة التهابية إلى حالة إصلاحية. يساعد هذا التغيير في الحد من تكوّن الندبات المفرط ويدعم تعافيًا وظيفيًا أفضل في النماذج قبل السريرية الموصوفة. «الخلايا البلعمية هي المفتاح»، قال هوانغ في إعلان الجامعة. «يمكنها إما أن تجعل الالتهاب أسوأ أو تساعد القلب على الشفاء. تساعد IL-4 في تحويلها إلى مساعدين».
محاولات سابقة لاستخدام IL-4 لإصلاح نسيج القلب اعتمدت على حقن في مجرى الدم، مما يدور الجزيء في جميع أنحاء الجسم ويؤدي إلى آثار غير مرغوب فيها في أعضاء أخرى. النهج المحلي بالإبر الدقيقة مصمم لتركيز العلاج على القلب مع تقليل التعرض الجهازي. «التوصيل الجهازي يؤثر على الجسم كله»، قال هوانغ. «كنا نريد استهداف القلب فقط».
أبلغ فريق الدراسة أيضًا عن تغييرات ملحوظة في سلوك خلايا عضلة القلب المعالجة، أو الكارديوميوسايتس، بعد تطبيق اللصقة. في دراسات المختبر والحيوانات، أصبحت الكارديوميوسايتس أكثر استجابة للإشارات من الأنسجة المحيطة، خاصة الخلايا البطانية التي تبطن الأوعية الدموية. قال هوانغ إن هذه التواصل الخلوي المحسن يبدو أنه يدعم التعافي. «لم تكن الكارديوميوسايتس مجرد ناجين، بل كانت تتفاعل مع خلايا أخرى بطرق تدعم التعافي»، لاحظ.
لاحظ الباحثون أن اللصقة قللت من الإشارات الالتهابية من الخلايا البطانية، التي يمكن أن تؤدي إلى تفاقم الضرر بعد نوبة قلبية. كما اكتشفوا زيادة في النشاط في مسار إشارة يُعرف بمسار NPR1، الذي يرتبط بصحة الأوعية الدموية ووظيفة القلب العامة.
حاليًا، يتطلب وضع اللصقة جراحة صدر مفتوح في نماذج الحيوانات المستخدمة. يقول هوانغ وزملاؤه إنهم يأملون في تكييف التكنولوجيا للتوصيل الأقل تدخلاً في المستقبل، متخيلين إصدارًا يمكن إدخاله عبر أنبوب صغير لجعله أكثر عملية في الإعدادات السريرية.
العمل، الذي مولته المعاهد الوطنية للصحة وجمعية القلب الأمريكية، نُشر في مجلة Cell Biomaterials. الدراسة، التي اختبرت اللصقة في نماذج احتشاء عضلة القلب في القوارض والخنازير، هي جهد في مرحلة مبكرة لإثبات المفهوم وغير متاحة بعد كعلاج للمرضى.
بالنظر إلى المستقبل، يتعاون هوانغ مع شياو تشينغ (جيد) وانغ، أستاذة مساعدة في الإحصاء في كلية الفنون والعلوم بجامعة تكساس إيه آند إم، في نموذج ذكاء اصطناعي لرسم الاستجابات المناعية وتوجيه العلاجات المناعية المعدلة المستقبلية. «هذا مجرد البداية»، قال هوانغ. «لقد أثبتنا المفهوم. الآن نريد تحسين التصميم والتوصيل».