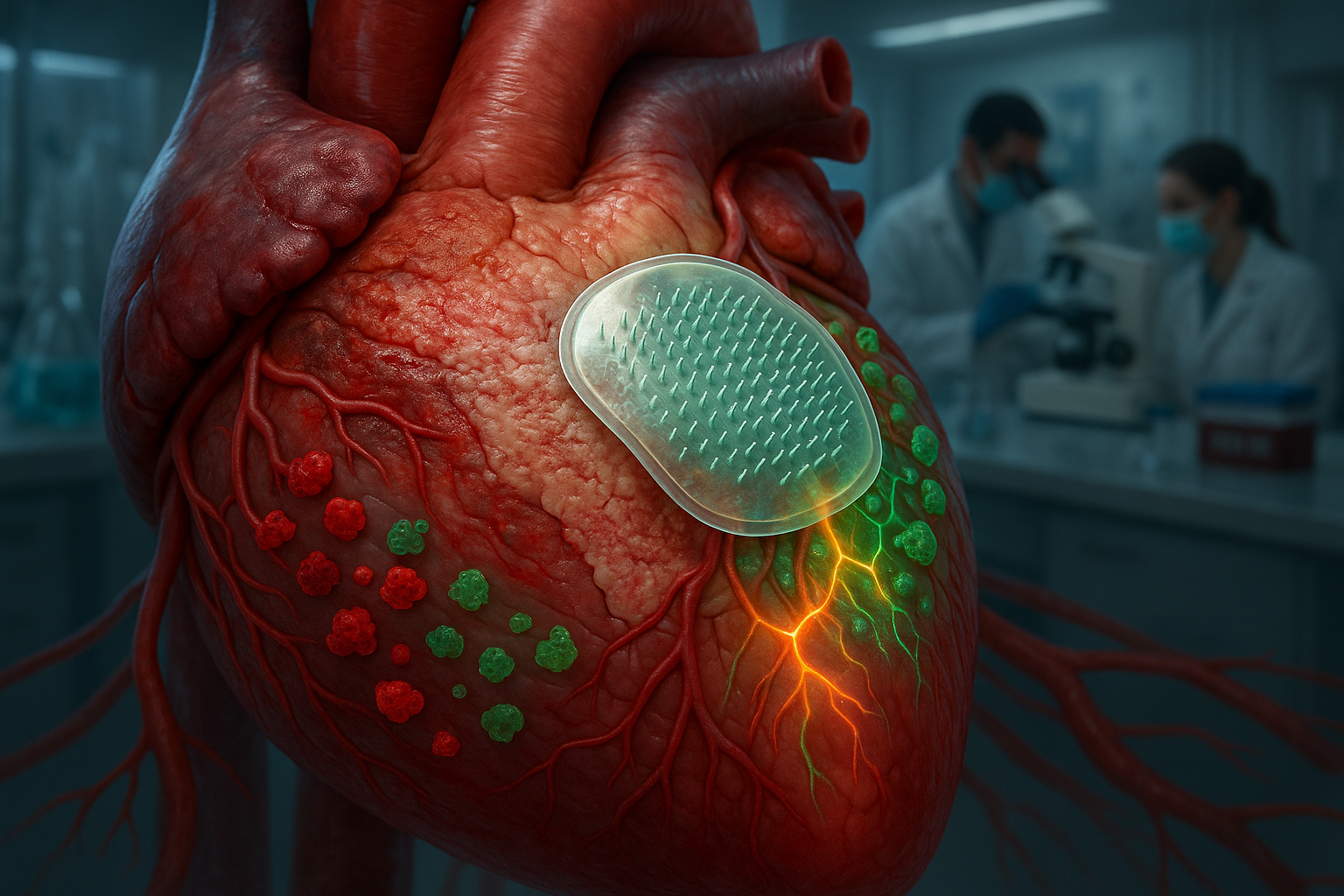
Ett team vid Texas A&M University har utvecklat ett biologiskt nedbrytbart mikronålsplåster som levererar interleukin-4 direkt till skadat hjärtvävnad efter en hjärtinfarkt. I prekliniska modeller skiftar denna riktade metod immun細胞 till läkningsläge och förbättrar kommunikationen mellan hjärtmuskelceller och blodkärlsceller, samtidigt som många biverkningar från systemisk läkemedelsleverans undviks.
Hjärtinfarkter berövar hjärtmuskelceller syre och näringsämnen, vilket leder till celldöd och bildning av ärrvävnad. Även om ärrbildningen stabiliserar det skadade området kan den inte dra ihop sig som frisk muskel, vilket tvingar den kvarvarande hjärtvävnaden att arbeta hårdare och potentiellt bidra till hjärtsvikt över tid.
För att tackla detta har ett team ledd av Dr. Ke Huang vid Texas A&M University skapat ett biologiskt nedbrytbart mikronålsplåster som levererar interleukin-4 (IL-4), en molekyl känd för att reglera immunsvar, direkt till skadat hjärtvävnad. Varje liten nål i plåstret innehåller mikroskopiska partiklar laddade med IL-4. När plåstret appliceras på hjärtats yta tränger mikronålarna genom det yttre lagret och löses upp, vilket frigör läkemedlet i den skadade muskeln under, enligt Texas A&Ms pressmeddelande.
Genom att koncentrera IL-4 vid skadeplatsen uppmuntrar plåstret makrofager —viktiga immun細胞— att skifta från pro-inflammatoriskt till reparativt tillstånd. Denna förändring begränsar överdriven ärrbildning och stöder bättre funktionell återhämtning i de beskrivna prekliniska modellerna. „Makrofager är nyckeln“, sade Huang i universitetets tillkännagivande. „De kan antingen förvärra inflammationen eller hjälpa hjärtat att läka. IL-4 hjälper dem att bli hjälpare.“
Tidigare försök att använda IL-4 för att reparera hjärtvävnad byggde på injektioner i blodströmmen, som spred molekylen i hela kroppen och ledde till oönskade effekter i andra organ. Den lokala mikronålsmetoden är utformad för att fokusera behandlingen på hjärtat samtidigt som systemexponeringen minimeras. „Systemisk leverans påverkar hela kroppen“, sade Huang. „Vi ville rikta oss enbart mot hjärtat.“
Studieteamet rapporterade också märkbara förändringar i hur behandlade hjärtmuskelceller, eller kardiomyocyter, betedde sig efter plåsterapplikation. I laboratoriet- och djurstudier blev kardiomyocyterna mer mottagliga för signaler från omgivande vävnader, särskilt endotelceller som täcker blodkärl. Huang sade att denna förbättrade cell-till-cell-kommunikation verkade stödja återhämtningen. „Kardiomyocyterna överlevde inte bara, de interagerade med andra celler på sätt som stödjer återhämtning“, noterade han.
Forskare observerade att plåstret minskade inflammatoriska signaler från endotelceller, som annars kan förvärra skadan efter hjärtinfarkt. De noterade också ökad aktivitet i en signalväg känd som NPR1-vägen, som är förknippad med blodkärlshälsa och hjärtfunktion i stort.
För närvarande kräver placering av plåstret öppen bröstkirurgi i de använda djurmodellerna. Huang och hans kollegor hoppas anpassa tekniken för minimalinvasiv leverans i framtiden, med visionen av en version som kan införas via ett litet rör för att göra den mer praktisk i kliniska miljöer.
Arbetet, finansierat av National Institutes of Health och American Heart Association, publicerades i tidskriften Cell Biomaterials. Studien, som testade plåstret i gnagare- och gris-modeller av myokardinfarkt, är ett tidigt skede proof-of-concept-arbete och är inte ännu tillgängligt som behandling för patienter.
Framåt samarbetar Huang med Xiaoqing (Jade) Wang, biträdande professor i statistik vid Texas A&Ms College of Arts and Sciences, kring en artificiell intelligens-modell för att kartlägga immunsvar och vägleda framtida immunmodulerande terapier. „Detta är bara början“, sade Huang. „Vi har bevisat konceptet. Nu vill vi optimera designen och leveransen.“