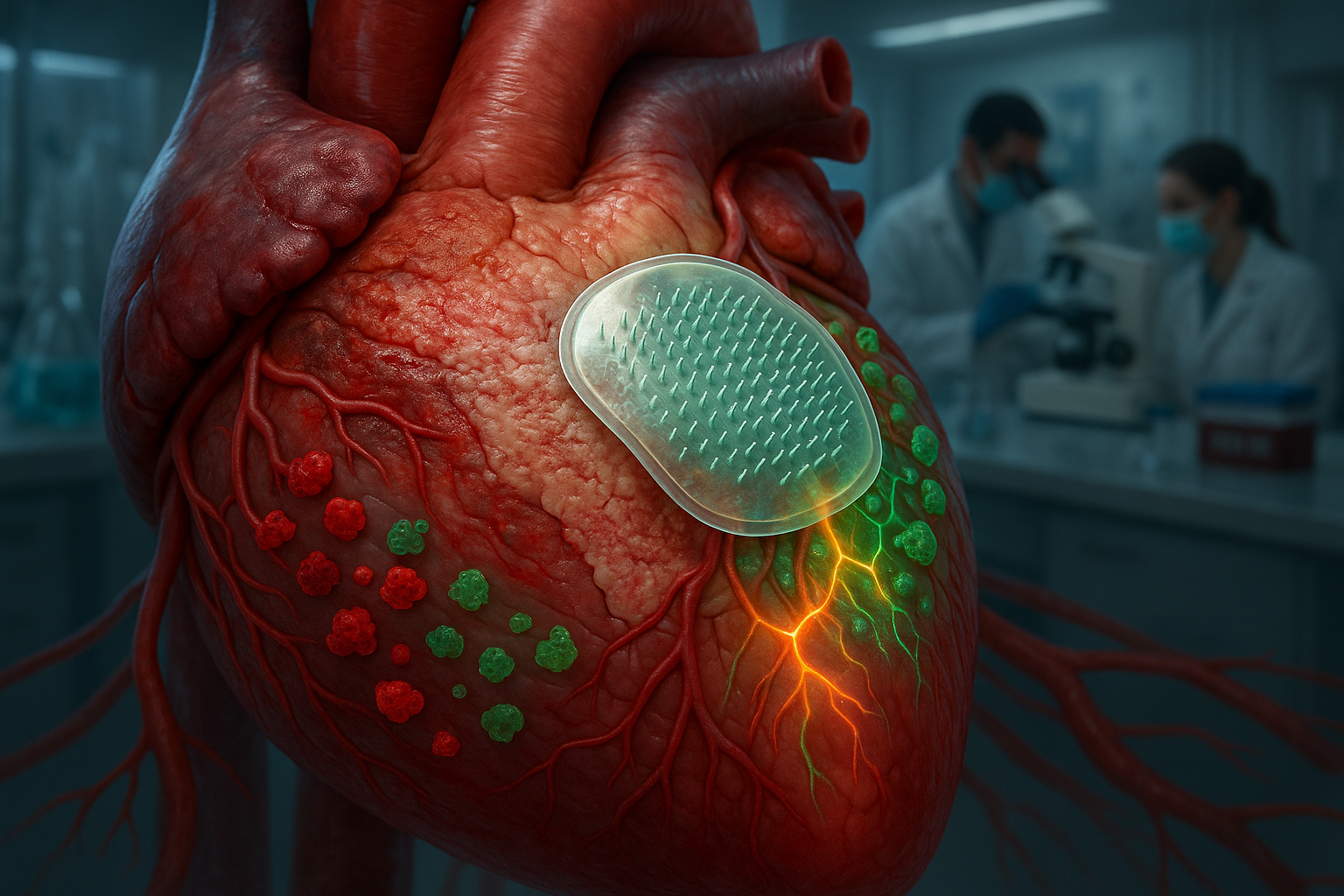
テキサスA&M大学のチームが、心筋梗塞後に損傷した心組織にインターロイキン-4を直接送達する生分解性マイクロニードルパッチを開発した。前臨床モデルでは、この標的アプローチが免疫細胞を治癒モードにシフトさせ、心筋細胞と血管細胞間の通信を改善し、全身薬物送達で見られる多くの副作用を回避する。
心筋梗塞は心筋細胞から酸素と栄養素を奪い、細胞死と瘢痕組織の形成を引き起こす。この瘢痕は損傷部位を安定させるのに役立つが、健康な筋肉のように収縮できず、残存心組織に過剰な負担をかけ、時間とともに心不全に寄与する可能性がある。
これに対処するため、テキサスA&M大学のKe Huang博士率いるチームは、免疫応答を調節する分子であるインターロイキン-4(IL-4)を損傷した心組織に直接送達する生分解性マイクロニードルパッチを作成した。パッチの各微小針にはIL-4を充填した微粒子が含まれる。パッチを心臓表面に適用すると、マイクロニードルが外層を貫通して溶解し、下の損傷筋肉に薬物を放出する、とテキサスA&Mの発表。
損傷部位にIL-4を集中させることで、パッチは重要な免疫細胞であるマクロファージをプロ炎症状態から修復状態へシフトさせる。この変化は過剰な瘢痕形成を制限し、記述された前臨床モデルでより良い機能回復を支援する。「マクロファージが鍵だ」とHuangは大学の発表で述べた。「炎症を悪化させるか、心の治癒を助けるか。IL-4はそれらをヘルパーへ変える。」
以前のIL-4による心組織修復の試みは血流への注射に依存し、分子が全身に循環して他の臓器に望ましくない影響を及ぼした。局所マイクロニードルアプローチは、心臓に治療を集中させ全身暴露を最小限に抑えるよう設計されている。「全身送達は全身に影響する」とHuang。「心臓だけを標的にしたかった。」
研究チームは、パッチ適用後の処理された心筋細胞(心筋細胞)の行動に顕著な変化を報告した。実験室と動物研究で、心筋細胞は周囲組織、特に血管内皮細胞からのシグナルに敏感になった。Huangはこの強化された細胞間通信が回復を支えると述べた。「心筋細胞は単に生き延びただけでなく、回復を支える方法で他の細胞と相互作用した」と指摘。
研究者らは、パッチが内皮細胞からの炎症シグナルを減らし、心筋梗塞後の損傷を悪化させるのを防ぐのを観察した。また、血管健康と全体的心機能に関連するNPR1経路の活性化を検出した。
現在、動物モデルではパッチの配置に開胸手術が必要。Huangと同僚らは将来の最小侵襲送達への適応を望み、小管を通じた挿入可能なバージョンを想定し、臨床現場でより実用的とする。
米国国立衛生研究所と米国心臓協会の資金によるこの研究はCell Biomaterials誌に掲載された。心筋梗塞のげっ歯類および豚モデルでパッチを試験したこの研究は初期段階の概念実証努力であり、患者治療としてまだ利用できない。
今後、HuangはテキサスA&Mの芸術・科学学部統計学助教授Xiaoqing (Jade) Wangと協力し、免疫応答をマッピングし将来の免疫調節療法を導くAIモデルを開発。「これは始まりに過ぎない」とHuang。「概念を証明した。今後は設計と送達を最適化したい。」