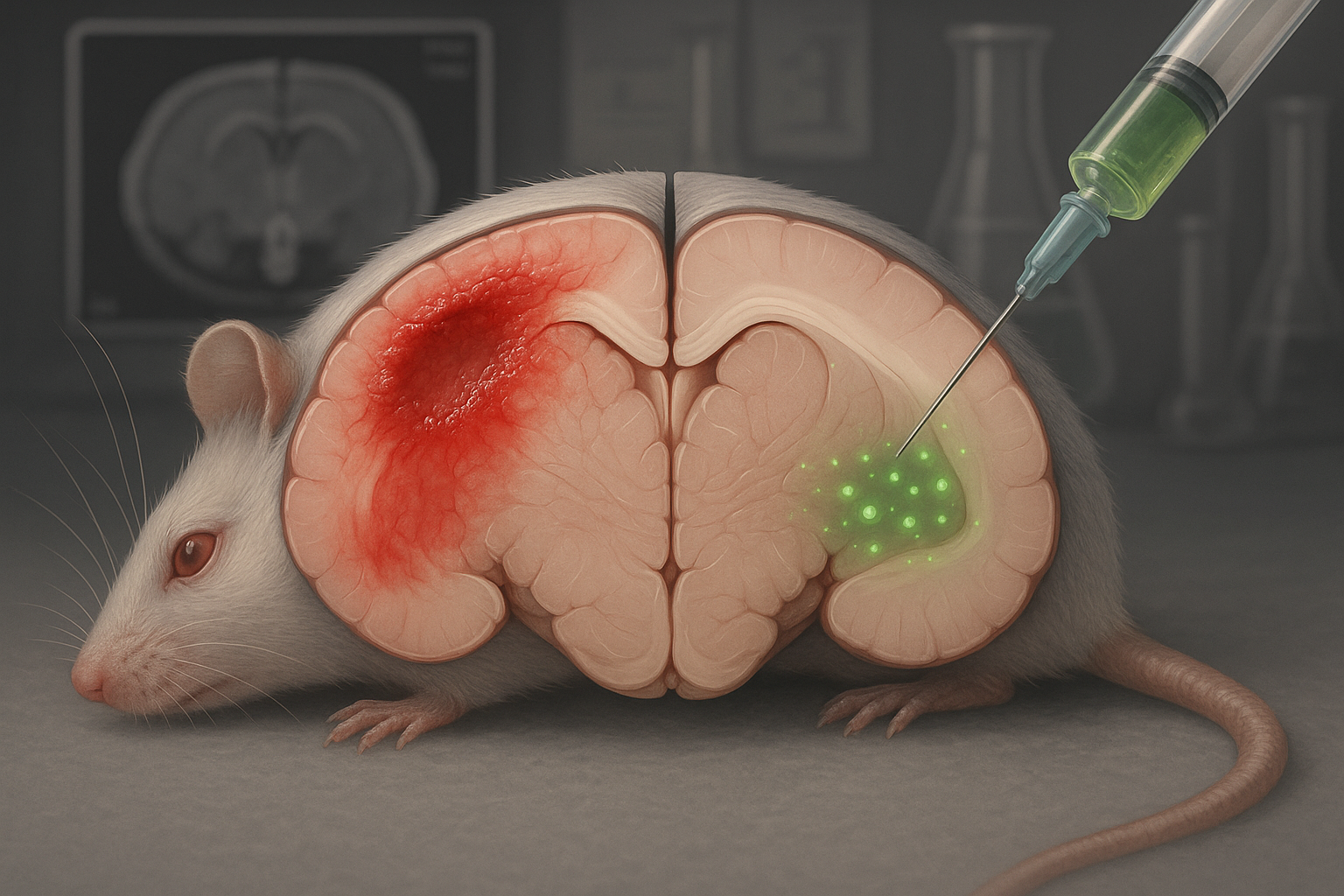
研究者らは、外傷性脳損傷後に静脈内投与されたCAQKというテトラペプチドが損傷した脳領域に蓄積し、マウスで病変サイズと炎症シグナルの減少と関連し、ブタでも同様の標的化が観察されたと報告。チームと関連スタートアップは、初期段階のヒト試験を開始するための米国FDA承認を求める計画だが、タイムラインは発表されていない。
学術界とスタートアップ企業の研究チームは、極めて短いペプチドCAQKを基盤とした外傷性脳損傷(TBI)治療の前臨床結果を報告した。
2025年10月にEMBO Molecular Medicineに掲載された研究で、著者らはCAQKを、中程度から重度の脳損傷直後に静脈内投与可能で、動物モデルにおいて損傷した脳組織に優先的に蓄積する神経保護「テトラペプチド」(4アミノ酸ペプチド)と記述している。
TBIは、交通事故、職場事故、転倒などの頭部打撲に一般的に続く。研究者らは、年間人口10万人あたり約200症例の発生率を挙げている。また、急性臨床ケアは主に患者の安定化(頭蓋内圧の制御や脳血流の維持など)に焦点を当てており、損傷による初期損害やその後の炎症・細胞死を含むカスケードを直接止める承認薬は現在存在しないと指摘している。
この新研究は、2016年に発表された先行研究に基づいており、同研究では全身投与後に急性脳損傷部位に「ホーミング」するペプチドとしてCAQKが特定された。当時の研究では、CAQKは損傷後にアップレギュレートされる細胞外マトリックスの標的と結合し、画像剤や治療ペイロードを損傷脳組織に送達する手段として検討された。
2025年の研究では、CAQK自体を治療として試験。損傷直後の静脈内投与後、マウスとブタの両方の損傷脳領域にペプチドが蓄積した。チームは、CAQKが損傷後に増加するグリコプロテイン・プロテオグリカン豊富な細胞外マトリックス成分に結合すると報告。
マウス実験では、CAQK投与群は対照群より病変が小さく、細胞死減少と損傷組織の炎症マーカー発現低下を示す測定値が得られた。研究者らは治療後の行動・記憶テストの改善を報告し、試験条件下で明らかな毒性を観察しなかった。
初著者アマン・P・マン氏は、損傷領域で「細胞死の減少と炎症マーカーの発現低下」を観察し、機能テストの結果が向上、「明らかな毒性なし」と述べた。共同著者パブロ・スコデラー氏は、ペプチドの単純さと製造容易性、組織浸透性と低免疫原性の好ましい特性がさらなる開発の有望な候補であると語った。
ScienceDailyの報道(スペイン国立研究評議会(CSIC)の資料に基づく)によると、研究著者と関連するスタートアップAivoCodeは、ヒトを対象とした第I相臨床試験開始に向け米国食品医薬品局(FDA)に許可を求める計画だが、同社はタイムラインを発表していない。
知見は前臨床段階であり、著者らはヒトでの安全性、投与量、有効性を確立するため追加研究が必要と強調している。