Investigadores informan que un tetrapeptido llamado CAQK, administrado por vía intravenosa después de una lesión cerebral traumática, se acumula en regiones cerebrales dañadas y se asocia con una reducción del tamaño de las lesiones y señales inflamatorias en ratones, con un direccionamiento similar observado en cerdos. El equipo y una startup relacionada dicen que planean solicitar la autorización de la FDA de EE.UU. para iniciar pruebas en humanos en etapas iniciales, aunque no se ha anunciado un cronograma.
Un equipo de investigadores de la academia y una empresa emergente ha informado de resultados preclínicos para una posible terapia contra la lesión cerebral traumática (TBI, por sus siglas en inglés) basada en un péptido extremadamente corto, CAQK.
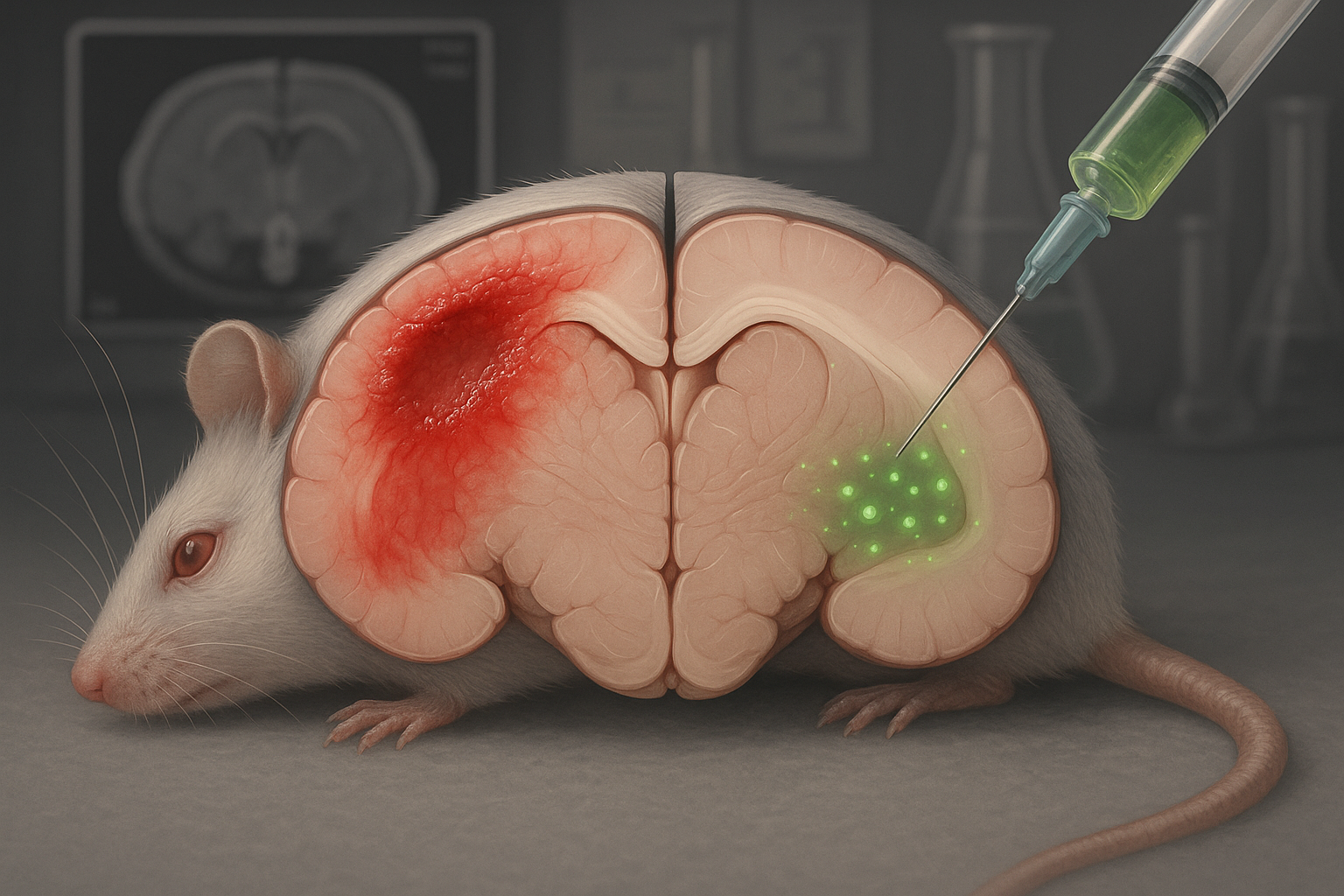
En un estudio publicado en EMBO Molecular Medicine en octubre de 2025, los autores describen a CAQK como un tetrapeptido neuroprotector (un péptido de cuatro aminoácidos) que puede administrarse por vía intravenosa poco después de una lesión cerebral moderada a grave y que se acumula preferentemente en el tejido cerebral dañado en modelos animales.
La TBI suele seguir a golpes en la cabeza en eventos como accidentes de tráfico, accidentes laborales y caídas. Los investigadores citan una estimación de incidencia de alrededor de 200 casos por 100.000 personas al año. También señalan que la atención clínica aguda se centra principalmente en estabilizar a los pacientes —como controlar la presión intracraneal y mantener el flujo sanguíneo cerebral— y que actualmente no hay fármacos aprobados que detengan directamente el daño inicial relacionado con la lesión o la cascada subsiguiente que puede incluir inflamación y muerte celular.
El nuevo trabajo se basa en una investigación anterior publicada en 2016 que identificó a CAQK como un péptido que «se dirige» a los sitios de lesión cerebral aguda después de la administración sistémica. En ese estudio anterior, se describió a CAQK como un péptido que se une a objetivos en la matriz extracelular que se sobreexpresan después de la lesión y se investigó como un medio para entregar agentes de imagen o cargas terapéuticas al tejido cerebral dañado.
En el estudio de 2025, los autores probaron a CAQK en sí mismo como terapia. Después de la dosificación intravenosa poco después de la lesión, el péptido se acumuló en regiones dañadas del cerebro tanto en ratones como en cerdos. El equipo informa que CAQK se une a componentes ricos en glicoproteínas y proteoglicanos de la matriz extracelular que aumentan después de la lesión.
En experimentos con ratones, los animales tratados con CAQK tuvieron lesiones más pequeñas que los controles, junto con medidas consistentes con una menor muerte celular y una menor expresión de marcadores inflamatorios en el tejido dañado. Los investigadores también informan de mejoras en pruebas de comportamiento y memoria después del tratamiento y afirman que no observaron toxicidad evidente en las condiciones del estudio.
El primer autor del estudio, Aman P. Mann, dijo que el equipo observó «menos muerte celular y menor expresión de marcadores inflamatorios» en el área dañada e informó de resultados mejorados en las pruebas funcionales «sin toxicidad evidente». El coautor Pablo Scodeller dijo que la simplicidad y fabricabilidad del péptido —junto con atributos que los investigadores describen como favorables para la penetración tisular y baja inmunogenicidad— lo convierten en un candidato prometedor para un mayor desarrollo.
Según un informe de ScienceDaily basado en materiales del Consejo Superior de Investigaciones Científicas (CSIC), la startup AivoCode —vinculada a los autores del estudio— planea solicitar permiso a la Administración de Alimentos y Medicamentos de EE.UU. para iniciar ensayos clínicos de fase I en humanos, aunque la empresa no ha anunciado un cronograma.
Los hallazgos siguen siendo preclínicos, y los autores enfatizan que se necesitarían estudios adicionales para establecer la seguridad, la dosificación y la eficacia en humanos.