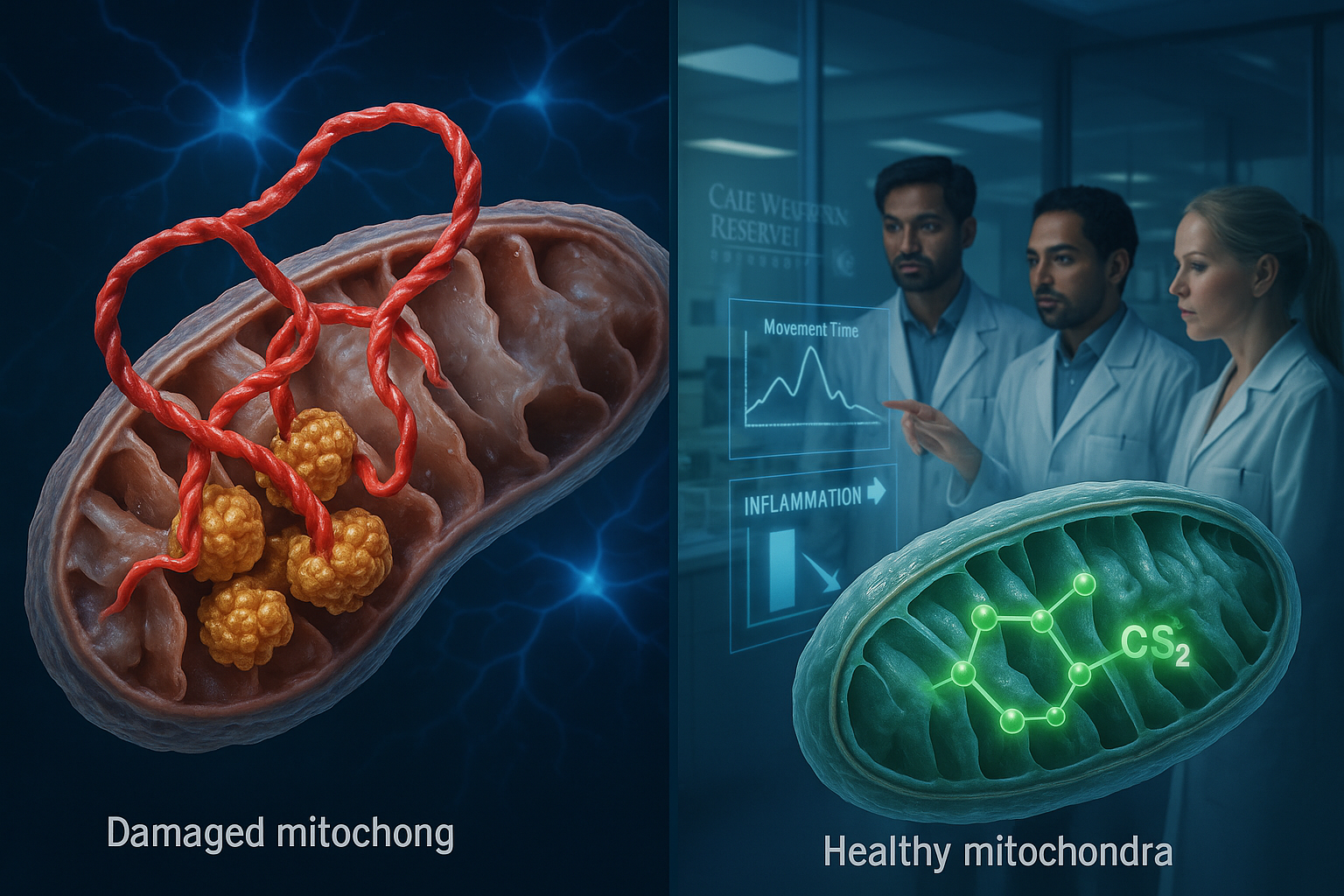
Case Western Reserve大学の研究者らは、パーキンソン関連タンパク質α-シヌクレインと酵素ClpPの異常な相互作用を特定し、実験モデルでミトコンドリア機能を乱すことを報告した。また、この相互作用を阻害するよう設計された実験化合物CS2を記述し、実験室およびマウス研究で運動と認知パフォーマンスが向上し、脳の炎症が減少したという。
パーキンソン病は米国で約100万人が罹患し、毎年約9万人の新規診断があると、パーキンソン財団によると。 Case Western Reserve大学の研究者らは、パーキンソン病がニューロンを損傷する仕組みを説明する分子相互作用を特定したと述べている。Molecular Neurodegenerationに掲載された研究で、チームはパーキンソン病で蓄積が知られるタンパク質α-シヌクレインがClpPという酵素に異常結合することを報告した。 研究者によると、ClpPは通常細胞の健康を維持するが、この異常結合がその機能を妨げ、ミトコンドリアの失敗を引き起こす。ミトコンドリアは細胞のエネルギー産生構造であり、研究ではその障害が神経変性を引き起こし脳細胞を失わせるとされる。また、この相互作用が複数の実験モデルでパーキンソン病の進行を加速させたことも報告された。 「私たちは、脳の細胞内発電所であるミトコンドリアを損傷する有害なタンパク質間相互作用を発見しました」と、研究の主任著者でCase Western Reserve医学校のJeanette M. and Joseph S. Silber脳科学教授であるXin Qi氏は述べた。「より重要なのは、この相互作用を阻害し、健康な脳細胞機能を回復させる標的アプローチを開発したことです。」 この効果に対抗するため、研究者らはCS2と呼ばれる実験治療を開発し、α-シヌクレインをClpPから引き離すおとりとして設計され、細胞のエネルギーシステムへの損傷を防ぐと説明している。 ヒト脳組織、患者由来ニューロン、マウスモデルを含む複数のモデルでのテストで、チームはCS2が脳の炎症を減少させ、運動と認知パフォーマンスの改善と関連したと報告した。 「これはパーキンソン病治療の根本的に新しいアプローチです」と、医学校生理学・生物物理学部門の研究科学者Di Hu氏は述べた。「症状を治療するだけでなく、疾患自体の根本原因の一つを標的としています。」 チームは次のステップとして、CS2の人体使用向けの改良、安全性・有効性テストの拡大、疾患進行に関連する分子バイオマーカーの特定を挙げ、長期目標としてヒト臨床試験への移行を目指すと述べた。