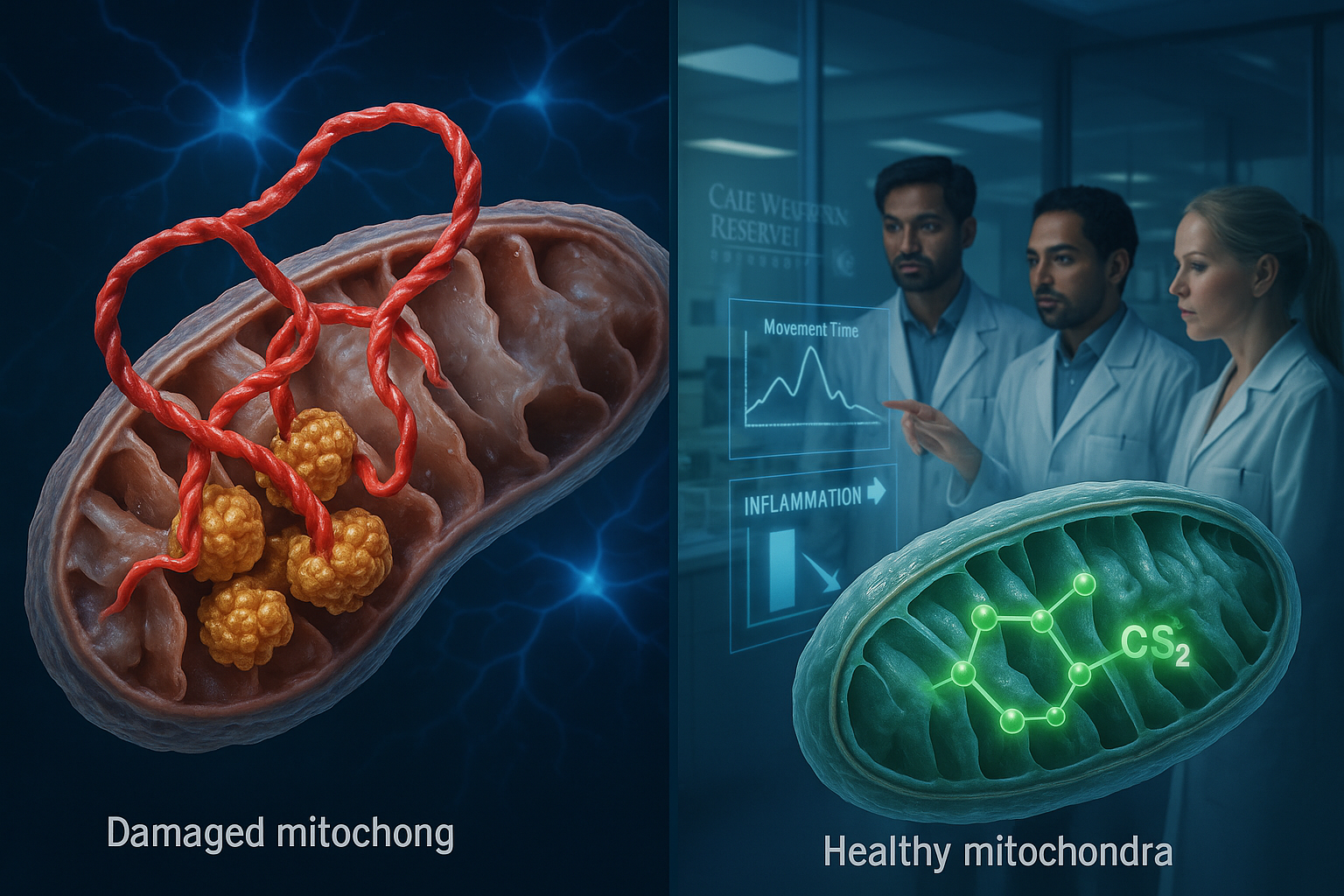
Peneliti di Case Western Reserve University melaporkan bahwa mereka telah mengidentifikasi interaksi abnormal antara protein alpha-synuclein terkait Parkinson dan enzim ClpP yang mengganggu fungsi mitokondria pada model eksperimental. Mereka juga menggambarkan senyawa eksperimental CS2 yang dirancang untuk memblokir interaksi tersebut, yang menurut mereka meningkatkan gerakan dan kinerja kognitif serta mengurangi peradangan otak dalam studi laboratorium dan tikus.
Penyakit Parkinson memengaruhi sekitar 1 juta orang di Amerika Serikat, dengan hampir 90.000 diagnosis baru setiap tahun, menurut Parkinson’s Foundation. Peneliti di Case Western Reserve University mengatakan bahwa mereka telah mengidentifikasi interaksi molekuler yang dapat membantu menjelaskan bagaimana penyakit Parkinson merusak neuron. Dalam studi yang diterbitkan di Molecular Neurodegeneration, tim melaporkan bahwa alpha-synuclein—protein yang diketahui menumpuk dalam penyakit Parkinson—dapat mengikat secara abnormal ke enzim yang disebut ClpP. Menurut peneliti, ClpP secara normal membantu menjaga kesehatan seluler, tetapi pengikatan abnormal mengganggu fungsinya dan berkontribusi pada kegagalan mitokondria. Mitokondria adalah struktur penghasil energi sel, dan studi tersebut menyatakan bahwa gangguan mereka dapat memicu neurodegenerasi dan kehilangan sel otak. Peneliti juga melaporkan bahwa interaksi ini mempercepat perkembangan Parkinson di berbagai model eksperimental. «Kami telah mengungkap interaksi berbahaya antara protein yang merusak pembangkit listrik seluler otak, yang disebut mitokondria,» kata Xin Qi, penulis senior studi dan Profesor Jeanette M. dan Joseph S. Silber Bidang Ilmu Otak di Case Western Reserve School of Medicine. «Yang lebih penting, kami telah mengembangkan pendekatan bertarget yang dapat memblokir interaksi ini dan memulihkan fungsi sel otak yang sehat.» Untuk melawan efek tersebut, peneliti mengembangkan perawatan eksperimental yang disebut CS2, yang mereka gambarkan sebagai umpan yang dirancang untuk menarik alpha-synuclein menjauh dari ClpP dan mencegah kerusakan pada sistem energi sel. Dalam pengujian di berbagai model—termasuk jaringan otak manusia, neuron berasal dari pasien, dan model tikus—tim melaporkan bahwa CS2 mengurangi peradangan otak dan dikaitkan dengan peningkatan gerakan dan kinerja kognitif. «Ini mewakili pendekatan baru secara fundamental untuk mengobati penyakit Parkinson,» kata Di Hu, ilmuwan peneliti di Departemen Fisiologi dan Biofisika School of Medicine. «Daripada hanya mengobati gejala, kami menargetkan salah satu penyebab akar penyakit itu sendiri.» Tim mengatakan langkah selanjutnya mencakup penyempurnaan CS2 untuk penggunaan potensial pada manusia, memperluas pengujian keamanan dan efektivitas, dan mengidentifikasi biomarker molekuler yang terkait dengan perkembangan penyakit, dengan tujuan jangka panjang menuju uji klinis manusia.