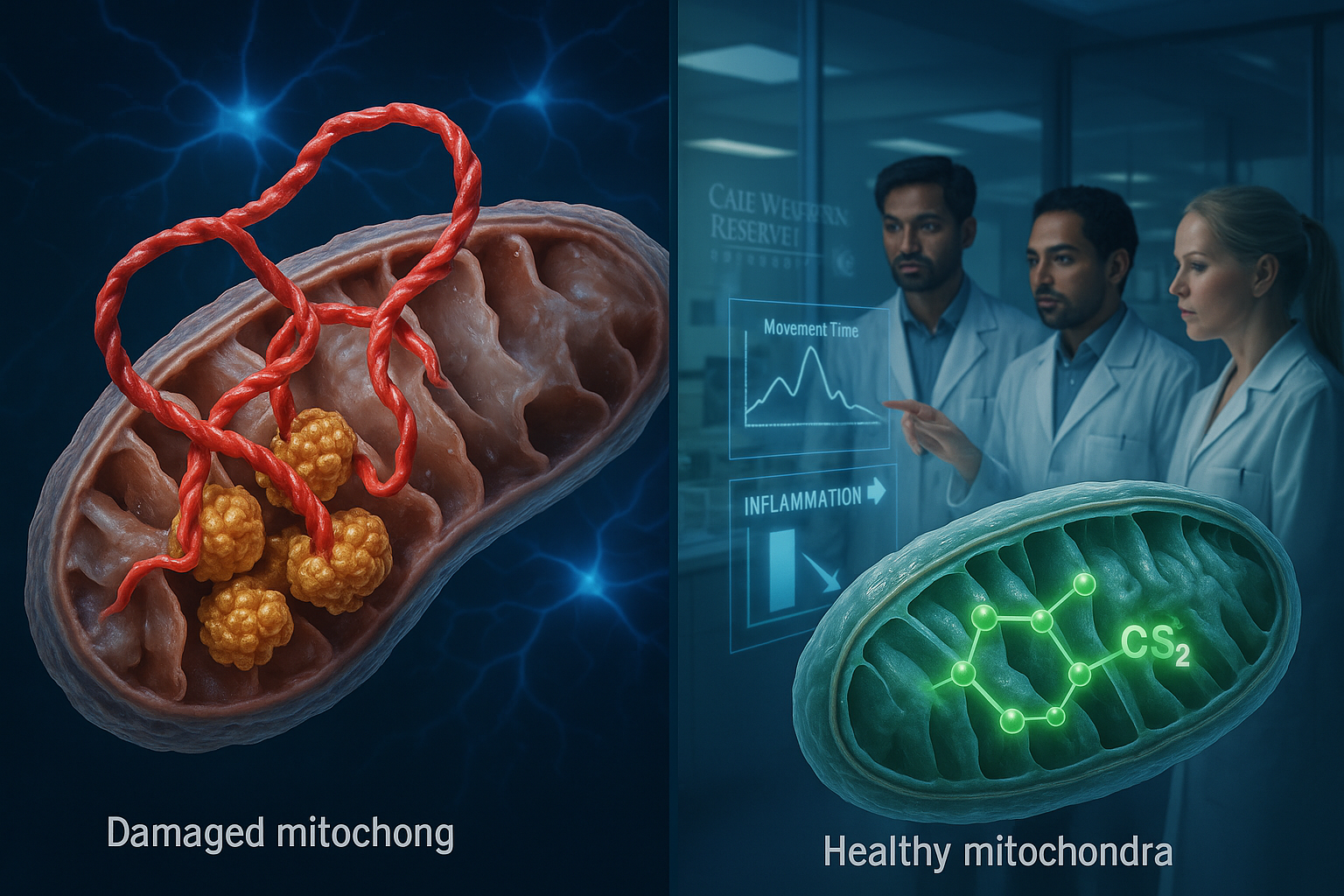
Forskare vid Case Western Reserve University rapporterar att de har identifierat en onormal interaktion mellan Parkinsonskopplade proteinet alpha-synuclein och enzymet ClpP som stör mitokondriefunktionen i experimentella modeller. De beskriver också en experimentell förening, CS2, utformad för att blockera denna interaktion, som enligt dem förbättrade rörelse och kognitiv prestation samt minskade hjärninflammation i labb- och musstudier.
Parkinsons sjukdom drabbar cirka 1 miljon människor i USA, med nästan 90 000 nya diagnoser varje år, enligt Parkinson’s Foundation. Forskare vid Case Western Reserve University säger att de har identifierat en molekylär interaktion som kan förklara hur Parkinsons sjukdom skadar nervceller. I en studie publicerad i Molecular Neurodegeneration rapporterar teamet att alpha-synuclein – ett protein som är känt för att ackumuleras vid Parkinsons sjukdom – kan binda onormalt till ett enzym kallat ClpP. Enligt forskarna hjälper ClpP normalt till att upprätthålla cellhälsa, men den onormala bindningen stör dess funktion och bidrar till mitokondriesvikt. Mitokondrierna är cellens energiproducerande strukturer, och studien säger att deras nedsättning kan utlösa neurodegeneration och förlust av hjärnceller. Forskarna rapporterade också att denna interaktion påskyndade Parkinsons progression i flera experimentella modeller. „Vi har upptäckt en skadlig interaktion mellan proteiner som skadar hjärnans cellkraftverk, kallade mitokondrier“, sa Xin Qi, studiens huvudförfattare och Jeanette M. och Joseph S. Silber-professor i hjärnvetenskap vid Case Western Reserve School of Medicine. „Viktigare är att vi har utvecklat en riktad metod som kan blockera denna interaktion och återställa frisk hjärncellsfunktion.“ För att motverka effekten utvecklade forskarna en experimentell behandling kallad CS2, som de beskriver som en lockbete utformad för att dra alpha-synuclein från ClpP och förhindra skador på cellens energisystem. I tester över flera modeller – inklusive humant hjärnvävnad, patient-deriveda neuroner och musmodeller – rapporterade teamet att CS2 minskade hjärninflammation och var associerat med förbättringar i rörelse och kognitiv prestation. „Detta representerar en fundamentalt ny strategi för att behandla Parkinsons sjukdom“, sa Di Hu, forskningsvetare vid School of Medicines avdelning för fysiologi och biofysik. „Istället för att bara behandla symtomen riktar vi in oss på en av sjukdomens grundorsaker.“ Teamet sa att nästa steg inkluderar att förfina CS2 för potentiell användning på människor, utöka säkerhets- och effektivitetsprovning samt identifiera molekylära biomarkörer kopplade till sjukdomsprogression, med långsiktigt mål att gå mot humana kliniska prövningar.