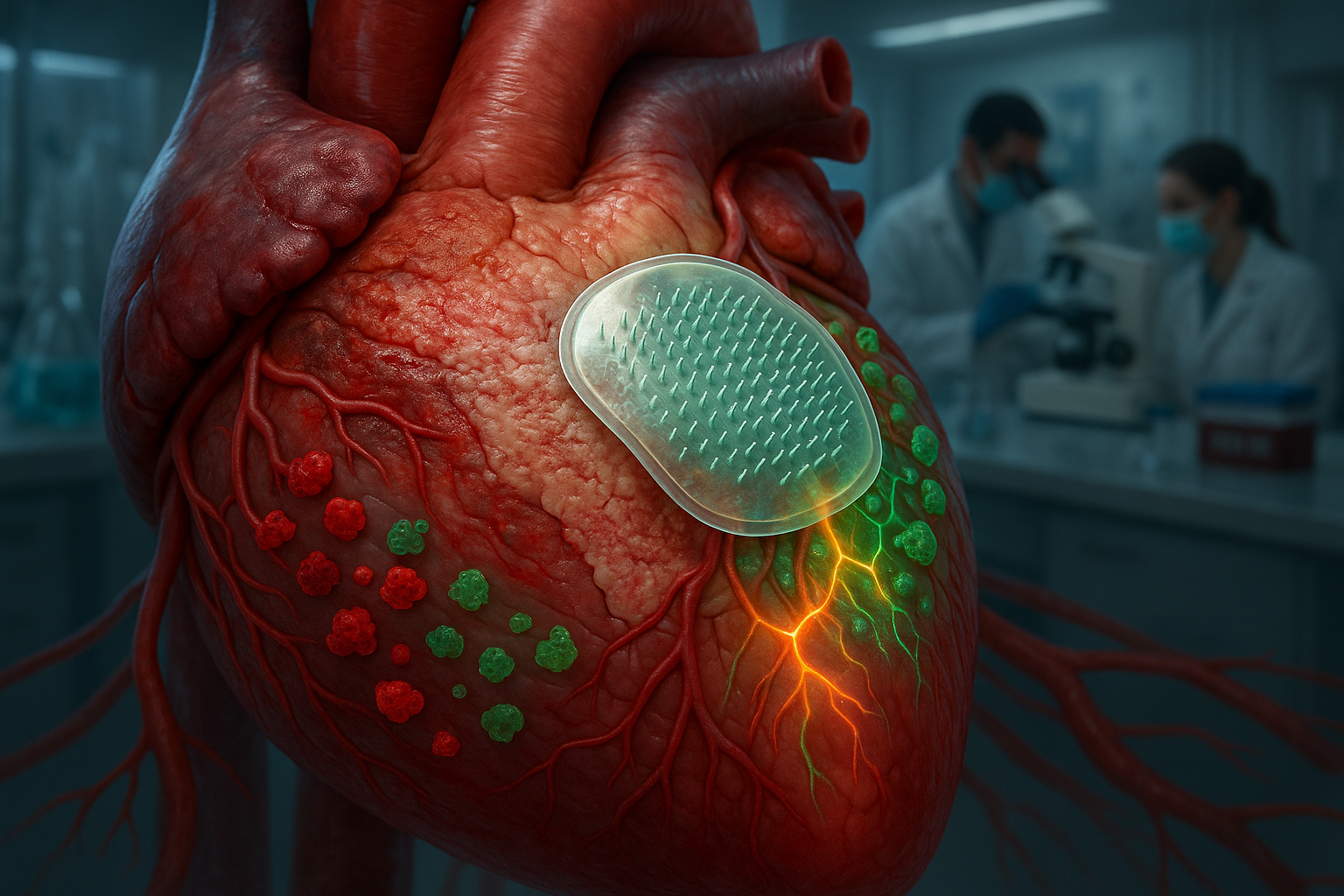
Tim Universitas Texas A&M telah mengembangkan tambalan mikroneedle biodegradable yang mengirimkan interleukin-4 langsung ke jaringan jantung yang rusak setelah serangan jantung. Dalam model praklinis, pendekatan bertarget ini mengubah sel imun ke mode penyembuhan dan meningkatkan komunikasi antara sel otot jantung dan sel pembuluh darah, sambil menghindari banyak efek samping yang terlihat pada pengiriman obat sistemik.
Serangan jantung merampas sel otot jantung dari oksigen dan nutrisi, menyebabkan kematian sel dan pembentukan jaringan parut. Meskipun jaringan parut ini membantu menstabilkan area yang rusak, itu tidak bisa berkontraksi seperti otot sehat, memaksa jaringan jantung yang tersisa bekerja lebih keras dan berpotensi berkontribusi pada gagal jantung seiring waktu.
Untuk mengatasi ini, tim yang dipimpin Dr. Ke Huang di Universitas Texas A&M telah menciptakan tambalan mikroneedle biodegradable yang mengirimkan interleukin-4 (IL-4), molekul yang dikenal mengatur respons imun, langsung ke jaringan jantung yang terluka. Setiap jarum kecil di tambalan berisi partikel mikroskopis yang dimuat dengan IL-4. Saat tambalan diterapkan pada permukaan jantung, mikroneedle menembus lapisan luar dan larut, melepaskan obat ke otot yang rusak di bawahnya, menurut rilis Texas A&M.
Dengan memusatkan IL-4 di lokasi cedera, tambalan mendorong makrofag —sel imun kunci— untuk beralih dari keadaan pro-inflamasi ke yang reparatif. Perubahan ini membantu membatasi pembentukan parut berlebih dan mendukung pemulihan fungsional yang lebih baik dalam model praklinis yang dijelaskan. “Makrofag adalah kuncinya,” kata Huang dalam pengumuman universitas. “Mereka bisa membuat peradangan lebih buruk atau membantu jantung sembuh. IL-4 membantu mengubahnya menjadi pembantu.”
Upaya sebelumnya untuk menggunakan IL-4 memperbaiki jaringan jantung mengandalkan suntikan ke aliran darah, yang menyebarkan molekul ke seluruh tubuh dan menyebabkan efek yang tidak diinginkan di organ lain. Pendekatan mikroneedle lokal dirancang untuk memfokuskan pengobatan pada jantung sambil meminimalkan paparan sistemik. “Pengiriman sistemik memengaruhi seluruh tubuh,” kata Huang. “Kami ingin menargetkan hanya jantung.”
Tim studi juga melaporkan perubahan mencolok dalam perilaku sel otot jantung yang diobati, atau kardiomiosit, setelah aplikasi tambalan. Dalam studi laboratorium dan hewan, kardiomiosit menjadi lebih responsif terhadap sinyal dari jaringan sekitar, terutama sel endotel yang melapisi pembuluh darah. Huang mengatakan komunikasi sel-ke-sel yang ditingkatkan ini tampak mendukung pemulihan. “Kardiomiosit tidak hanya bertahan, mereka berinteraksi dengan sel lain dengan cara yang mendukung pemulihan,” catatnya.
Peneliti mengamati bahwa tambalan mengurangi sinyal inflamasi dari sel endotel, yang sebaliknya dapat memperburuk kerusakan setelah serangan jantung. Mereka juga mendeteksi peningkatan aktivitas dalam rute sinyal yang dikenal sebagai jalur NPR1, yang terkait dengan kesehatan pembuluh darah dan fungsi jantung secara keseluruhan.
Saat ini, menempatkan tambalan memerlukan operasi dada terbuka pada model hewan yang digunakan. Huang dan koleganya mengatakan mereka berharap menyesuaikan teknologi untuk pengiriman minimally invasive di masa depan, membayangkan versi yang dapat dimasukkan melalui tabung kecil untuk membuatnya lebih praktis dalam pengaturan klinis.
Pekerjaan ini, didanai oleh National Institutes of Health dan American Heart Association, diterbitkan di jurnal Cell Biomaterials. Studi tersebut, yang menguji tambalan pada model infark miokard rodensia dan babi, adalah upaya proof-of-concept tahap awal dan belum tersedia sebagai pengobatan untuk pasien.
Melihat ke depan, Huang berkolaborasi dengan Xiaoqing (Jade) Wang, asisten profesor statistik di College of Arts and Sciences Texas A&M, pada model kecerdasan buatan untuk memetakan respons imun dan memandu terapi imunomodulatori masa depan. “Ini baru permulaan,” kata Huang. “Kami telah membuktikan konsepnya. Sekarang kami ingin mengoptimalkan desain dan pengiriman.”