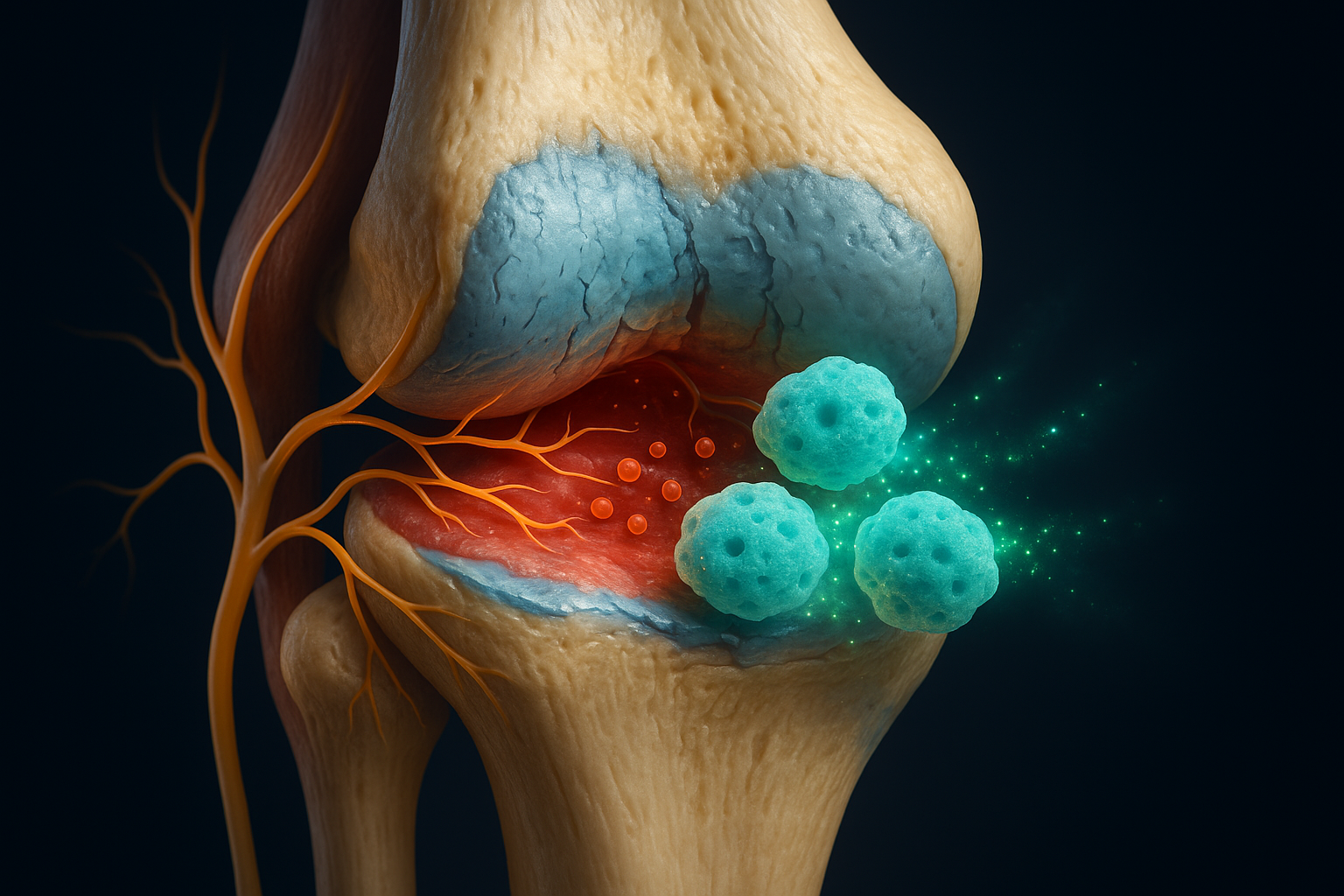
أعلنت شركة SereNeuro Therapeutics عن بيانات ما قبل السريرية واعدة لـ SN101، وهي علاج قائم على الخلايا الجذعية متعددة القدرات المستحثة لألم التهاب المفاصل التنكسي المزمن. يستخدم العلاج عصبونات حسية للألم طرفية معدلة وراثياً والتي تحتجز عوامل الألم الالتهابية دون نقل إشارات الألم، بينما تطلق جزيئات تجديدية قد تساعد في الحفاظ على الغضروف، وفقاً لبيانات قدمت في ندوة للجمعية الدولية لأبحاث الخلايا الجذعية.
في 12 ديسمبر، خلال ندوة للجمعية الدولية لأبحاث الخلايا الجذعية (ISSCR) في كامبريدج، ماساتشوستس، كشفت شركة SereNeuro Therapeutics، وهي شركة بيوتكنولوجيا ما قبل السريرية تطور علاجات للألم غير أفيونية، عن بيانات جديدة حول SN101، وهي علاج مستمد من الخلايا الجذعية متعددة القدرات المستحثة (iPSCs).
يتكون SN101 من عصبونات حسية للألم طرفية ناضجة مستمدة من iPSCs، المعروفة باسم nociceptors، ويتم تطويره لعلاج ألم المفاصل المزمن الناتج عن التهاب المفاصل التنكسي. يُقدم النهج كعلاج خلوي من الطراز الأول يبتعد عن استراتيجيات إدارة الألم التقليدية.
وفقاً لمواد الجمعية الدولية لأبحاث الخلايا الجذعية، تعمل عصبونات SN101 كـ"إسفنجة علاجية للألم" لجزيئات الألم الالتهابية. بدلاً من نقل إشارات الألم إلى الدماغ، تحتجز الخلايا عوامل الألم الالتهابية محلياً داخل المفصل، مما تشير البيانات ما قبل السريرية إلى أنه يمكن أن يقلل من الإشارات المتعلقة بالألم. بالإضافة إلى ذلك، تفرز العصبونات عوامل تجديدية مؤكدة آلياً، مما يخلق بيئة تدعم الحفاظ على أنسجة المفصل وتوقف تدهور الغضروف في النماذج ما قبل السريرية، مما يضع SN101 كدواء محتمل لتعديل المرض في التهاب المفاصل التنكسي (DMOAD).
"نهجنا يستخدم nociceptors مستمدة من iPSCs عالية النقاء (SN101) التي تعمل بفعالية كإسفنجة لعوامل الألم. من خلال حقن خلايا SN101، ن خفف الألم بشكل غير متوقع ونوقف تدهور الغضروف"، أوضح Gabsang Lee، المؤسس العلمي المشترك لـ SereNeuro وأستاذ علم الأعصاب وعلم الأعصاب في جامعة Johns Hopkins، في تصريحات أصدرتها ISSCR والمنافذ الشريكة.
يتميز العلاج عن الخيارات الناشئة مثل مثبطات قناة الأيون Nav1.8، التي تركز على مسار واحد متعلق بالألم. بالمقابل، تعبر خلايا SN101 بشكل طبيعي عن مجموعة واسعة من مستقبلات الألم القياسية وقنوات الأيونات، مما يسمح للعلاج بتأثير آليات متعددة للألم والالتهاب في وقت واحد، وفقاً لملخص ISSCR والتقارير الإخبارية ذات الصلة.
يُقارن SN101 أيضاً بحقن الكورتيكوستيرويدات، وهي علاج قياسي شائع لألم التهاب المفاصل التنكسي. يمكن للكورتيكوستيرويدات تقديم راحة أعراض قصيرة الأمد لكنها ارتبطت بتسريع تدهور الغضروف مع مرور الوقت.
"علاجات الرعاية القياسية الحالية، خاصة الكورتيكوستيرويدات، توفر راحة مؤقتة لكنها معروفة بتسريع تدهور الغضروف مع مرور الوقت، مما يفاقم المرض في النهاية"، لاحظ الدكتور Daniël Saris، عضو مجلس الاستشاريين السريريين في SereNeuro وأستاذ جراحة العظام والطب الإعادي في عيادة Mayo، في بيان ISSCR.
في الدراسات ما قبل السريرية التي لخصتها ISSCR والبيانات الصحفية التابعة، أظهر SN101 تخفيف سلوكيات الألم المزمن في نماذج حيوانية مع دعم الحفاظ على هيكل الغضروف والعظم في المفاصل المعالجة. بما أن العلاج يستخدم خلايا غير أفيونية، ناضجة تماماً، غير مقسمة، يقول المطورون إنه مصمم لتجنب مخاطر الإدمان المرتبطة بمسكنات الألم الأفيونية وتقليل مخاوف الإتومورية المرئية في بعض العلاجات الخلوية المتكاثرة.
هذه النتائج ما زالت ما قبل السريرية، ولم يدخل SN101 بعد التجارب البشرية. ومع ذلك، تبرز البيانات تحولاً نحو استراتيجيات خلوية غير أفيونية تهدف ليس فقط إلى تخفيف ألم التهاب المفاصل التنكسي المزمن بل أيضاً إلى حماية ومحافظة محتملة على أنسجة المفصل مع مرور الوقت.