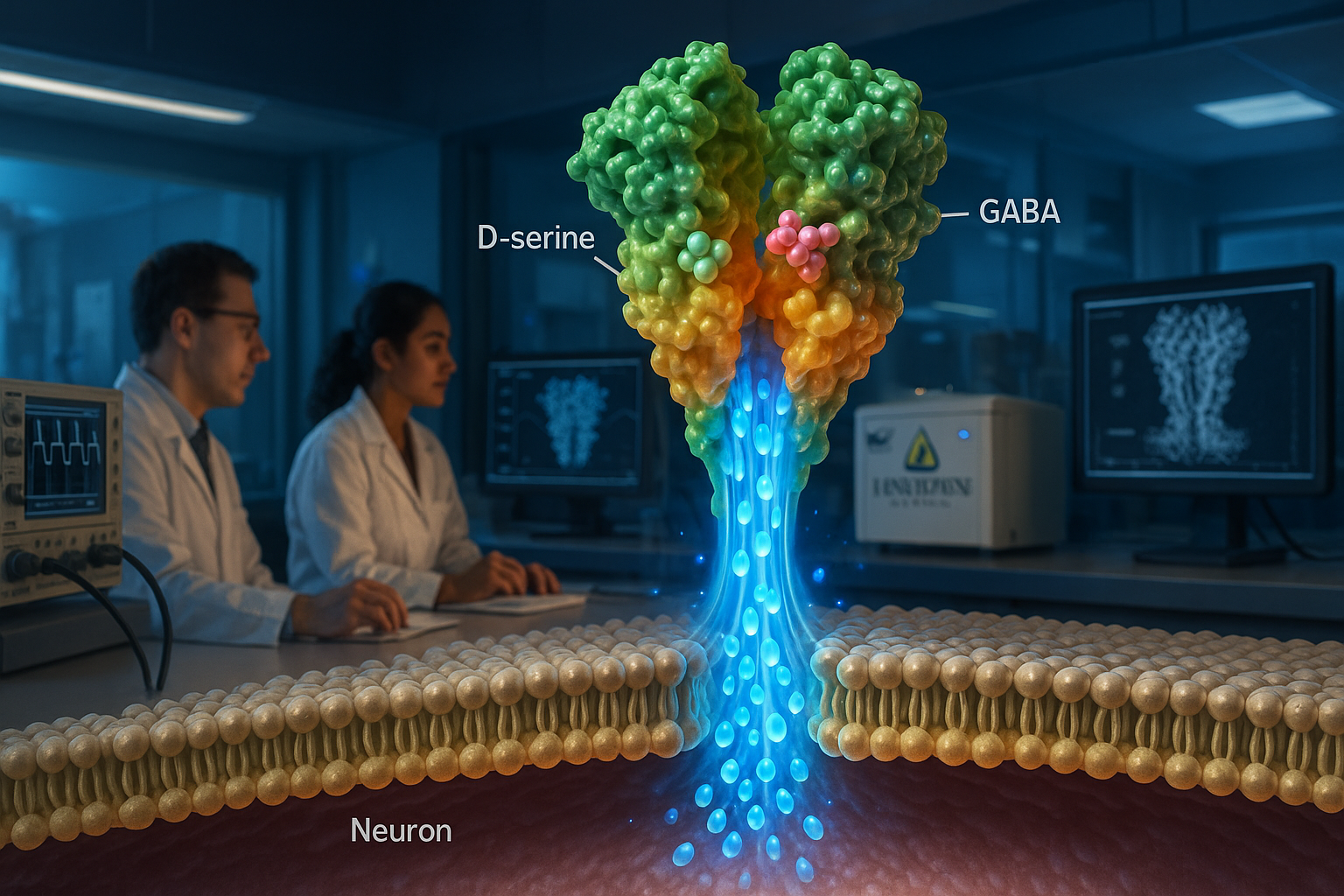
Peneliti Johns Hopkins Medicine melaporkan bahwa reseptor glutamat ionotropik tipe delta (GluDs)—yang lama diperdebatkan apakah dapat mengalirkan ion—dapat bertindak sebagai saluran ion yang diaktifkan ligan. Studi *Nature* menggunakan mikroskopi krioelektron dan eksperimen perekaman membran untuk mengkarakterisasi GluD2 manusia dan menemukan bahwa itu dapat diaktifkan oleh neurotransmiter D-serin dan GABA, temuan yang menurut penulis dapat membantu memandu pengembangan obat untuk gangguan yang terkait dengan mutasi GluD.
Peneliti di Johns Hopkins Medicine mengatakan mereka telah mengklarifikasi pertanyaan lama tentang apakah reseptor glutamat ionotropik tipe delta, yang dikenal sebagai GluDs, dapat berfungsi sebagai saluran ion. Dalam makalah yang diterbitkan di Nature, tim melaporkan bahwa hGluD2 manusia yang dimurnikan berperilaku sebagai saluran ion yang diaktifkan ligan in vitro. Peneliti menggunakan mikroskopi krioelektron bersama dengan eksperimen perekaman listrik membran untuk mengkarakterisasi struktur reseptor dan aktivitas salurannya. “Kelas protein ini telah lama dianggap duduk tidak aktif di otak,” kata Edward Twomey, Ph.D., asisten profesor biophysika dan kimia biofisika di Johns Hopkins University School of Medicine, menurut rilis Johns Hopkins Medicine yang dibawa oleh ScienceDaily. Studi melaporkan bahwa hGluD2 dapat diaktifkan oleh neurotransmiter D-serin dan GABA, dan aktivasi lebih kuat pada suhu fisiologis. Penulis juga menggambarkan bagaimana domain pengikatan ligan reseptor dikaitkan dengan pori saluran ion, memberikan penjelasan struktural tentang bagaimana pengikatan dapat memicu pembukaan saluran. Peneliti juga memeriksa mutasi titik yang terkait dengan ataxia serebelar di domain pengikatan ligan dan melaporkan bahwa itu mengubah arsitektur reseptor dan dapat menghasilkan arus 'kebocor' dalam eksperimen mereka. Johns Hopkins Medicine mengatakan temuan tersebut dapat membantu memberi informasi upaya untuk merancang obat yang memodulasi aktivitas GluD pada gangguan yang terkait dengan mutasi GluD, termasuk kondisi psikiatris seperti kecemasan dan skizofrenia, dan gangguan neurologis yang memengaruhi gerakan. Artikel Nature mencantumkan Haobo Wang, Fairine Ahmed, Jeffrey Khau, dan Anish Kumar Mondal sebagai co-author dengan Twomey. ScienceDaily, mengutip bahan Johns Hopkins Medicine, juga melaporkan bahwa Johns Hopkins University telah mengajukan paten yang mencakup teknik yang digunakan untuk mengukur arus listrik dari GluDs dan bahwa pekerjaan itu didanai oleh National Institutes of Health, Searle Scholars Program, dan Diana Helis Henry Medical Research Foundation. Makalah berjudul “Delta-type glutamate receptors are ligand-gated ion channels” dan muncul di Nature (volume 647, isu 8091, halaman 1063–1071; diterbitkan secara online 16 Sept. 2025; tanggal isu 27 Nov. 2025).