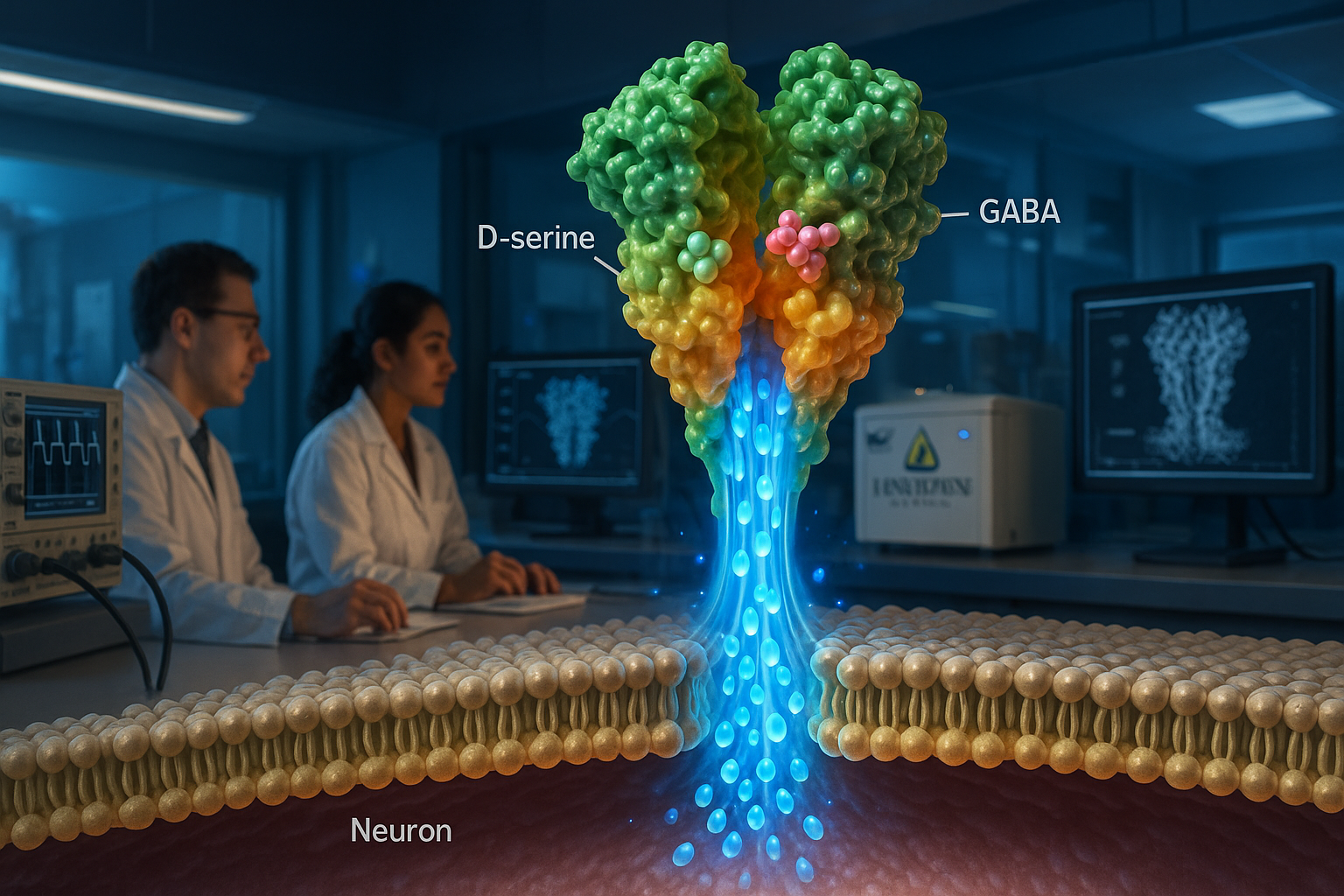
Forskare vid Johns Hopkins Medicine rapporterar att delta-typ ionotropiska glutamatreceptorer (GluDs) – som länge debatterats om de leder joner – kan fungera som ligandstyrda jonkanaler. *Nature*-studien använde kryo-elektronmikroskopi och membranregistreringsexperiment för att karakterisera humant GluD2 och fann att det kan aktiveras av signalsubstanserna D-serin och GABA, fynd som författarna säger kan vägleda läkemedelsutveckling för sjukdomar kopplade till GluD-mutationer.
Forskare vid Johns Hopkins Medicine säger att de har klargjort den långvariga frågan om delta-typ ionotropiska glutamatreceptorer, kända som GluDs, kan fungera som jonkanaler. I en artikel publicerad i Nature rapporterar teamet att renat humant GluD2 (hGluD2) beter sig som en ligandstyrd jonkanal in vitro. Forskarnas använde kryo-elektronmikroskopi tillsammans med membraneléktiska registreringsexperiment för att karakterisera receptorens struktur och kanalaktivitet. ”Denna klass av protein har länge ansetts vara vilande i hjärnan”, sa Edward Twomey, Ph.D., biträdande professor i biofysik och biofysikalisk kemi vid Johns Hopkins University School of Medicine, enligt ett pressmeddelande från Johns Hopkins Medicine som återgetts av ScienceDaily. Studien rapporterar att hGluD2 kan aktiveras av signalsubstanserna D-serin och GABA, och att aktiveringen är starkare vid fysiologiska temperaturer. Författarna beskriver också hur receptorens ligandbindningsdomäner är kopplade till en jonkanalpor, vilket ger en strukturell förklaring till hur bindning kan utlösa kanalöppning. Forskare undersökte också en punktmutation kopplad till cerebellär ataxi i ligandbindningsdomänen och rapporterar att den förändrar receptorarkitekturen och kan producera så kallade ”läckströmmar” i deras experiment. Johns Hopkins Medicine säger att fynden kan hjälpa till att informera ansträngningar att utforma läkemedel som modulerar GluD-aktivitet vid sjukdomar associerade med GluD-mutationer, inklusive psykiatriska tillstånd som ångest och schizofreni, samt neurologiska sjukdomar som påverkar rörelse. Nature-artikeln listar Haobo Wang, Fairine Ahmed, Jeffrey Khau och Anish Kumar Mondal som medförfattare med Twomey. ScienceDaily, med hänvisning till material från Johns Hopkins Medicine, rapporterar också att Johns Hopkins University har ansökt om patent som täcker tekniker använda för att mäta elektriska strömmar från GluDs och att arbetet finansierades av National Institutes of Health, Searle Scholars Program och Diana Helis Henry Medical Research Foundation. Artikeln har titeln ”Delta-type glutamate receptors are ligand-gated ion channels” och publiceras i Nature (volym 647, nummer 8091, sidor 1063–1071; publicerad online 16 sept. 2025; nummerdatum 27 nov. 2025).