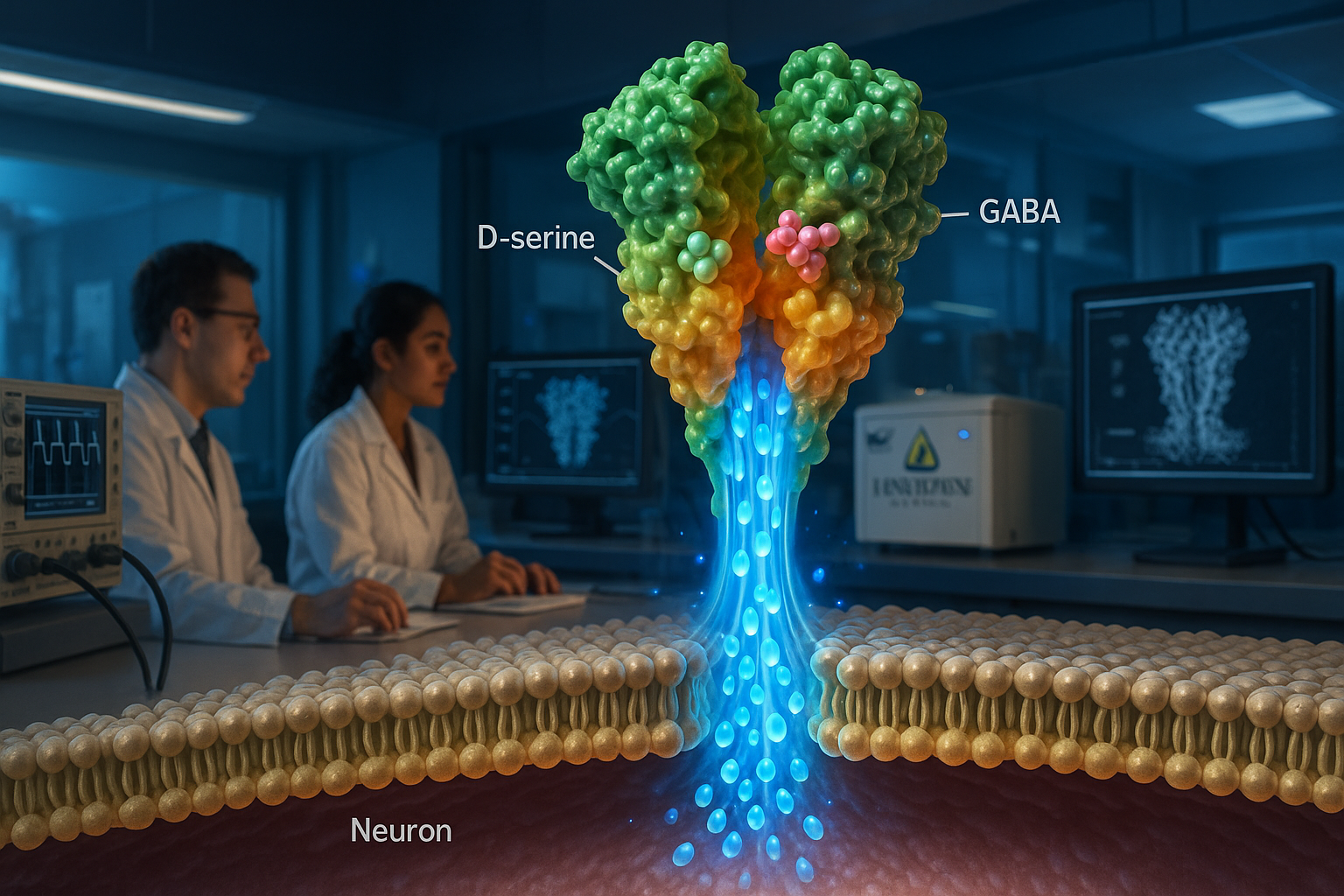
Investigadores de Johns Hopkins Medicine informan que los receptores ionotrópicos de glutamato tipo delta (GluDs) —largamente debatidos en cuanto a si conducen iones— pueden actuar como canales iónicos activados por ligando. El estudio en *Nature* utilizó microscopia crioelectrónica y experimentos de registro de membrana para caracterizar el GluD2 humano y encontró que puede activarse con los neurotransmisores D-serina y GABA, hallazgos que los autores dicen podrían ayudar a guiar el desarrollo de fármacos para trastornos relacionados con mutaciones en GluD.
Investigadores de Johns Hopkins Medicine dicen que han aclarado la pregunta de larga data sobre si los receptores ionotrópicos de glutamato tipo delta, conocidos como GluDs, pueden funcionar como canales iónicos. En un artículo publicado en Nature, el equipo informa que el GluD2 humano purificado (hGluD2) se comporta como un canal iónico activado por ligando in vitro. Los investigadores utilizaron microscopia crioelectrónica junto con experimentos de registro eléctrico de membrana para caracterizar la estructura y la actividad del canal del receptor. “Esta clase de proteína ha sido considerada durante mucho tiempo como inactiva en el cerebro”, dijo Edward Twomey, Ph.D., profesor asistente de biofísica y química biofísica en la Escuela de Medicina de la Universidad Johns Hopkins, según un comunicado de Johns Hopkins Medicine difundido por ScienceDaily. El estudio informa que el hGluD2 puede activarse con los neurotransmisores D-serina y GABA, y que la activación es más fuerte a temperaturas fisiológicas. Los autores también describen cómo los dominios de unión a ligandos del receptor están acoplados a un poro de canal iónico, proporcionando una explicación estructural de cómo la unión puede desencadenar la apertura del canal. Los investigadores también examinaron una mutación puntual relacionada con la ataxia cerebelosa en el dominio de unión a ligandos e informan que altera la arquitectura del receptor y puede producir corrientes de “fuga” en sus experimentos. Johns Hopkins Medicine dijo que los hallazgos pueden ayudar a informar los esfuerzos para diseñar fármacos que modulen la actividad de GluD en trastornos asociados con mutaciones en GluD, incluidos trastornos psiquiátricos como la ansiedad y la esquizofrenia, y trastornos neurológicos que afectan el movimiento. El artículo de Nature lista a Haobo Wang, Fairine Ahmed, Jeffrey Khau y Anish Kumar Mondal como coautores con Twomey. ScienceDaily, citando materiales de Johns Hopkins Medicine, también informa que la Universidad Johns Hopkins ha presentado una patente que cubre las técnicas utilizadas para medir corrientes eléctricas de GluDs y que el trabajo fue financiado por los National Institutes of Health, el Searle Scholars Program y la Diana Helis Henry Medical Research Foundation. El artículo se titula “Delta-type glutamate receptors are ligand-gated ion channels” y aparece en Nature (volumen 647, número 8091, páginas 1063–1071; publicado en línea el 16 de septiembre de 2025; fecha del número 27 de noviembre de 2025).