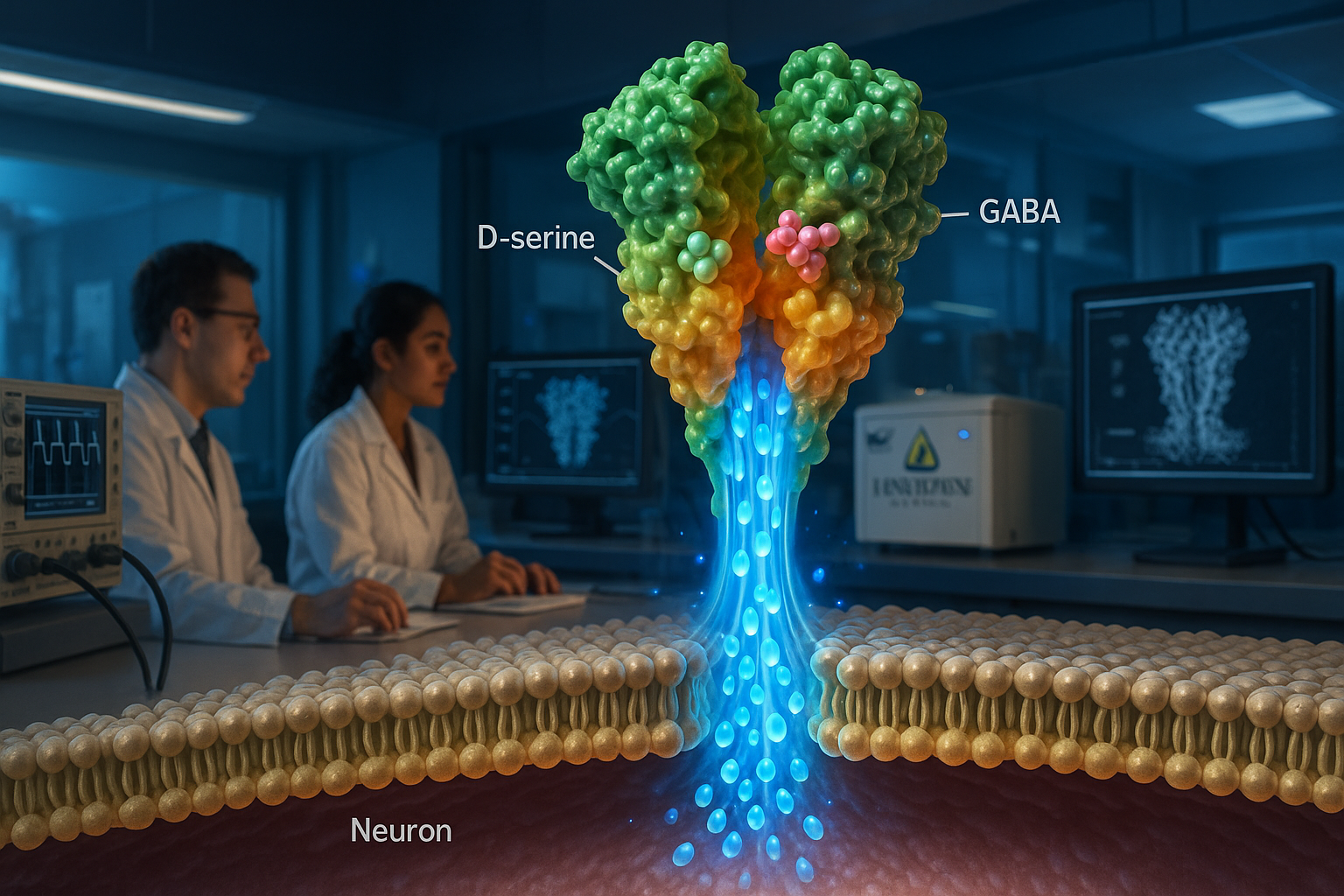
ジョンズ・ホプキンス・メディシン研究者らは、δ型イオノトロピックグルタミン酸受容体(GluD)がイオン伝導性を持つかどうかが長年議論されてきたが、リガンド依存性イオンチャネルとして機能し得ると報告した。*Nature*の研究では、クライオ電子顕微鏡と膜記録実験を用いてヒトGluD2を特徴づけ、D-セリンおよびGABAという神経伝達物質で活性化されることがわかり、著者らはこれがGluD変異に関連する疾患に対する薬剤開発の指針になると述べている。
ジョンズ・ホプキンス・メディシンの研究者らは、δ型イオノトロピックグルタミン酸受容体(GluD)がイオンチャネルとして機能するかどうかの長年の疑問を明らかにしたと述べている。Natureに掲載された論文で、チームは精製したヒトGluD2(hGluD2)がin vitroでリガンド依存性イオンチャネルとして振る舞うことを報告した。研究者らはクライオ電子顕微鏡と膜電気記録実験を併用して、受容体の構造とチャネル活性を特徴づけた。「このタンパク質クラスは長らく脳内で休眠状態にあると考えられてきた」と、ジョンズ・ホプキンス大学医学部の生体物理学および生体物理化学助教授エドワード・トゥーミー博士は、ScienceDailyが伝えたジョンズ・ホプキンス・メディシンのリリースで述べた。研究では、hGluD2がD-セリンおよびGABAで活性化され、生理温度で活性化が強まることを報告した。著者らはまた、受容体のリガンド結合ドメインがイオンチャネルポアに結合している様子を記述し、結合がチャネル開口を誘導する構造的説明を提供した。研究者らはまた、小脳失調症関連の点突然変異をリガンド結合ドメインで調べ、これが受容体構造を変え、実験でいわゆる「漏れ電流」を生じさせることを報告した。ジョンズ・ホプキンス・メディシンは、これらの知見がGluD変異関連疾患(不安や統合失調症などの精神疾患や運動に影響する神経疾患)に対するGluD活性調節薬の設計に役立つ可能性があると述べた。Nature論文はトゥーミーと共著者のHaobo Wang、Fairine Ahmed、Jeffrey Khau、Anish Kumar Mondalを挙げている。ScienceDailyはジョンズ・ホプキンス・メディシンの資料を引用し、ジョンズ・ホプキンス大学がGluDからの電流測定技術をカバーする特許を出願し、研究は国立衛生研究所、Searle Scholars Program、Diana Helis Henry Medical Research Foundationの資金によるものであると報じた。論文タイトルは「Delta-type glutamate receptors are ligand-gated ion channels」で、Nature(巻647、号8091、pp.1063–1071;2025年9月16日オンライン公開;号の日付2025年11月27日)に掲載。