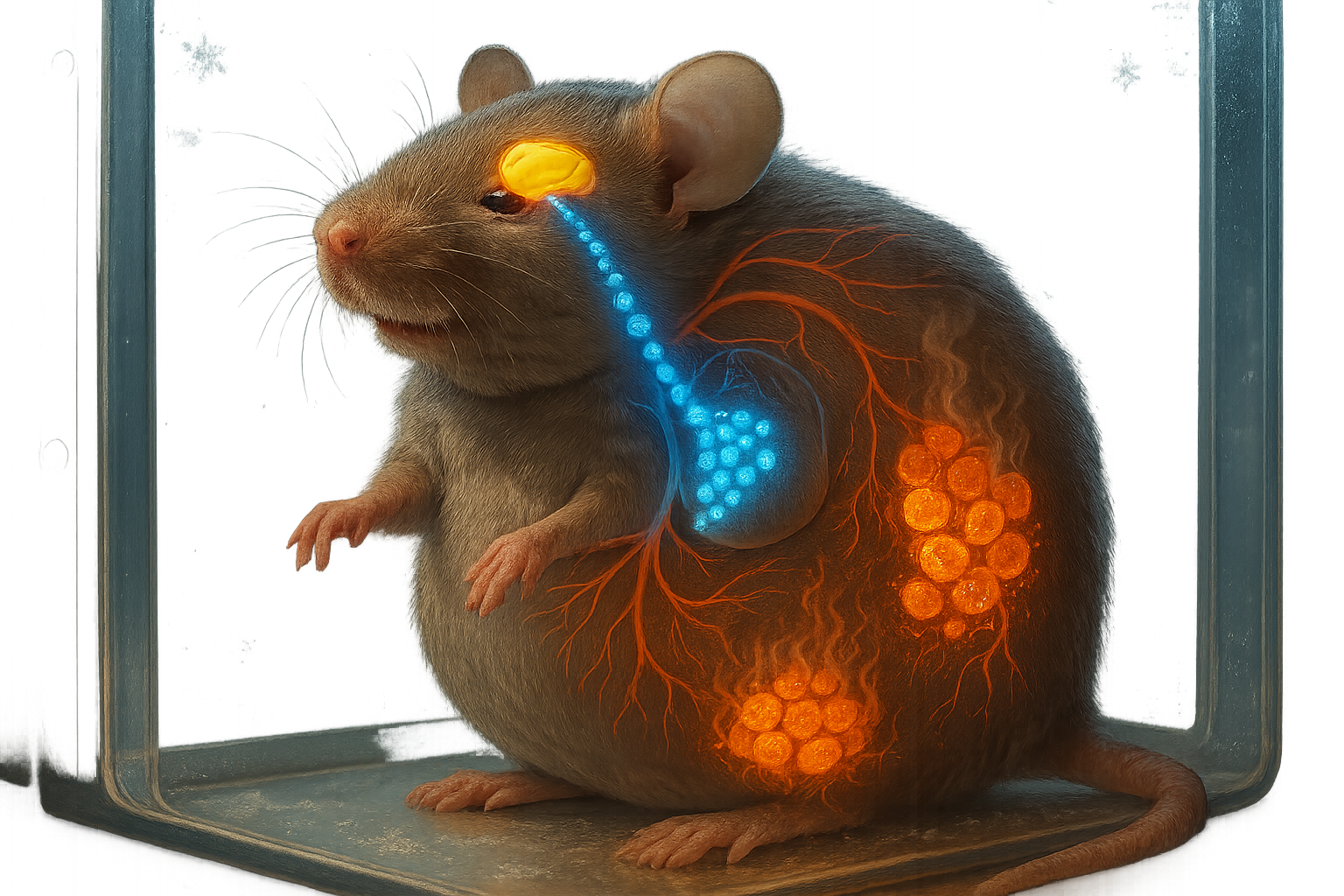
肥満マウスを対象とした研究で、腸由来のホルモンFGF19が脳にシグナルを送り、エネルギー消費を増加させ脂肪燃焼細胞を活性化することが判明。視床下部と交感神経系を介して作用するこのメカニズムは、サーモジェネシスと寒冷耐性を向上させ、肥満と糖尿病の新たな治療法開発に役立つ可能性がある。
ブラジルのカンピナス州立大学(UNICAMP)の研究者らは、FGF19ホルモンが視床下部に作用してエネルギー代謝に影響を与えることを報告。視床下部は体と環境からのシグナルに対する応答を調整する脳領域である。
研究では、食事誘発性肥満マウスにFGF19を脳内に直接投与した。American Journal of Physiology – Endocrinology and Metabolismに掲載された論文によると、中枢FGF19シグナルは交感神経系の活動を高め、エネルギー消費を増加させ、褐色脂肪および鼠径部(白色)脂肪組織でのサーモジェネシスを刺激し、脂肪細胞がカロリーを蓄積する代わりに熱としてエネルギーを燃焼させた。肥満マウスは全体的なエネルギー恒常性が改善し、末梢炎症が減少し、グルコース-インスリン制御が向上し、寒冷曝露に対する耐性も向上した。
この研究は、FGF19が主に小腸で産生され、胆汁酸および肝臓でのグルコース・脂質代謝を調節することを示した従来の研究を基盤としつつ、脳でのあまり探求されていない効果を強調している。著者らは、寒冷曝露が視床下部で特異的にFGF19受容体とコ受容体の発現を上方制御することを発見し、体温調節とエネルギー平衡における適応的役割を示唆している。
「FGF19はすでに食物摂取量の減少と関連づけられていた。私たちの研究は、視床下部に作用して白色および褐色脂肪組織でのエネルギー消費増加を刺激することから、それ自体が重要な役割を果たすことを新たに示した。つまり、食欲制御に加えてサーモジェネシスを刺激する。したがって、肥満関連療法の観点から見て非常に理にかなっている」、UNICAMPのObesity and Comorbidities Research Center (OCRC)のHelena Cristina de Lima Barbosa教授は、FAPESPが報じたコメントで述べた。
Barbosa教授の指導のもと博士課程学生のLucas Zangerolamoが主導したこの研究は、サンパウロ研究財団(FAPESP)の資金援助を受け、ハーバード医学校のJoslin Diabetes Center(共著者Yu‑Hua Tseng氏在籍)と共同で行われた。FGF19に応答する脳細胞を特定するため、チームは成体マウス視床下部の公開シングルセルRNAシーケンシングデータセットを集積・解析した。50,000個以上の個別細胞での転写を評価し、FGF19受容体を発現する特定の視床下部細胞群を同定した。
著者らは、次のステップとして、体内のFGF19自家産生を増加させる方法を解明し、この経路が食事誘発性脳炎症や摂食行動を調節する神経回路とどのように交差するかを明らかにする必要があると述べている。
この発見は、世界的に肥満が依然として増加する中でなされたものだ。World Atlas of Obesity 2025によると、現在10億人以上が肥満に苦しんでおり、予防・治療策が強化されなければ、2030年までにこの数は15億人を上回ると予測されている。
今年初めに同誌で注目されたAmerican Journal of Physiology – Endocrinology and Metabolismに掲載されたこの研究は、脳と脂肪組織でのFGF19作用を模倣する薬剤が、将来的に肥満・糖尿病の既存ホルモン療法を補完する可能性を示唆している。現在市販のOzempic(成分:semaglutide)などの薬は、GLP‑1受容体を活性化して脳に満腹シグナルを送り食物摂取を減らすが、本研究はエネルギー消費を直接増加させるFGF19を新たな治療標的として指摘している。