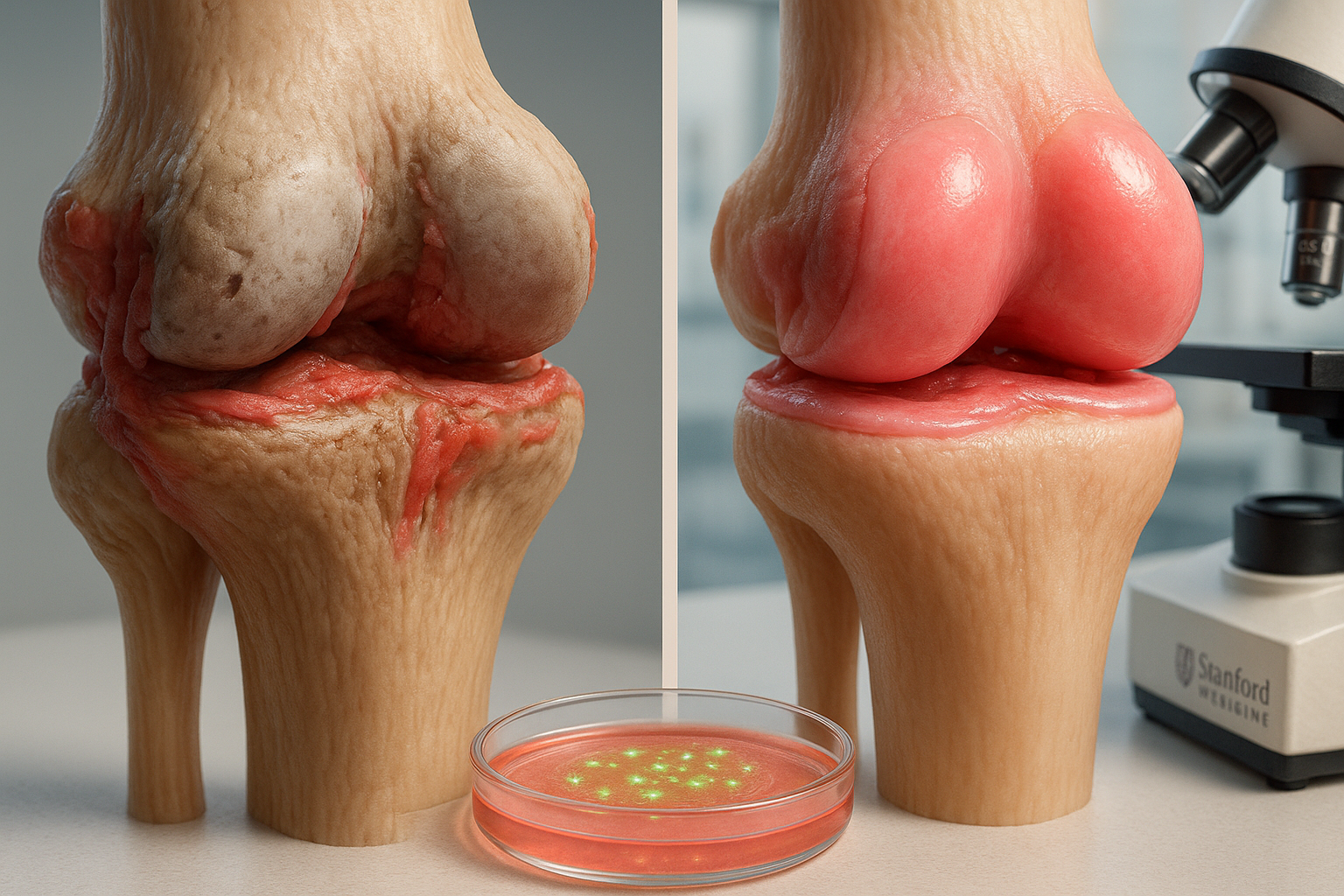
Investigadores de Stanford Medicine informan que bloquear la enzima 15-PGDH revirtió la pérdida de cartílago relacionada con la edad en ratones mayores y redujo el daño similar a la osteoartritis tras lesiones de rodilla tipo ACL. En experimentos de laboratorio, cartílago extraído de cirugías de reemplazo de rodilla también mostró signos tempranos de regeneración tras la exposición al inhibidor, hallazgos publicados en *Science*.
La osteoartritis afecta a cerca de uno de cada cinco adultos en Estados Unidos y está asociada a unos 65.000 millones de dólares al año en costos directos de atención sanitaria, según el resumen del trabajo de Stanford Medicine. La atención actual se centra principalmente en el alivio de síntomas o el reemplazo quirúrgico de articulaciones, y no hay fármacos aprobados que puedan ralentizar o revertir el daño subyacente del cartílago. En un estudio publicado en Science, científicos de Stanford Medicine se centraron en la 15-hidroxi prostaglandina deshidrogenasa (15-PGDH), una enzima que describen como un «gerozima» porque sus niveles aumentan con la edad. El equipo informó que los niveles de 15-PGDH aumentaron en el cartílago articular de ratones envejecidos y en ratones con lesiones articulares, y que inhibir la enzima alteró el comportamiento de las células del cartílago de manera consistente con la reparación. En ratones mayores, los investigadores encontraron que el tratamiento con un inhibidor de 15-PGDH de molécula pequeña —administrado de forma sistémica o inyectado en la rodilla— engrosó el cartílago en toda la superficie de la articulación. Las pruebas indicaron que el nuevo tejido era cartílago hialino (articular), en lugar de fibrocartílago, que suele ser menos funcional. El mismo inhibidor también redujo el desarrollo de osteoartritis en un modelo de ratón de lesión de rodilla similar a una rotura de ACL. El estudio informó que los ratones tratados dos veces por semana durante cuatro semanas después de la lesión tenían menos probabilidades de desarrollar osteoartritis y mostraban un mejor movimiento y soporte de peso en la extremidad lesionada que los animales no tratados. Los investigadores también probaron cartílago humano extraído de pacientes sometidos a reemplazo total de rodilla por osteoartritis. Tras una semana de exposición al inhibidor en el laboratorio, el tejido mostró menos células productoras de 15-PGDH, menor expresión de genes asociados con la degradación del cartílago y el fibrocartílago, y signos tempranos consistentes con la regeneración del cartílago articular. El estudio sugiere que la reparación del cartílago ocurrió sin activar células madre. En cambio, los análisis indicaron que las células del cartílago existentes (condrocitos) cambiaron sus programas de expresión génica hacia un estado más juvenil y productor de matriz. «Esta es una nueva forma de regenerar tejido adulto, y tiene un significativo potencial clínico para tratar la artritis debida al envejecimiento o a lesiones», dijo la autora principal Helen Blau, profesora de microbiología e inmunología de Stanford, en el comunicado de Stanford Medicine. La coautora principal Nidhi Bhutani, profesora asociada de cirugía ortopédica de Stanford, dijo que el inhibidor «provoca una regeneración dramática del cartílago». Los investigadores señalaron que un inhibidor oral de 15-PGDH ya se está evaluando en ensayos clínicos de fase 1 dirigidos a la debilidad muscular relacionada con la edad, y dijeron que esperan que se lancen ensayos humanos similares para probar la regeneración del cartílago.